XARELTO®
BAYER
rivaroxabana
Antitrombótico.
Apresentações.
Xarelto® (rivaroxabana) é apresentado na forma de comprimidos revestidos em cartucho com blíster contendo 10 ou 30 comprimidos revestidos.
USO ORAL
USO ADULTO
Composição.
Cada comprimido revestido contém 10 mg de rivaroxabana. Excipientes: celulose microcristalina, croscarmelose sódica, hipromelose, lactose monoidratada, estearato de magnésio, laurilsulfato de sódio, óxido férrico vermelho, macrogol, dióxido de titânio
Indicações.
Xarelto®(rivaroxabana) é indicado para a prevenção de tromboembolismo venoso (TEV) em pacientes adultos submetidos a cirurgia eletiva de artroplastia de joelho ou quadril.
Resultados de eficácia.
Prevenção de eventos tromboembólicos venosos (TEV) em pacientes submetidos a cirurgia ortopédica de grande porte dos membros inferiores.
O programa clínico da rivaroxabana foi elaborado para demonstrar a eficácia de Xarelto®(rivaroxabana) para a prevenção de eventos tromboembólicos venosos (TEV), por exemplo, trombose venosa profunda (TVP) proximal e distal e embolia pulmonar (EP) em pacientes submetidos a cirurgia ortopédica de grande porte dos membros inferiores. Mais de 9.500 pacientes (7.050 em cirurgia de artroplastia total do quadril e 2.531 em cirurgia de artroplastia total do joelho) foram estudados em estudos clínicos de fase III controlados, duplo-cegos, randomizados, programa RECORD.
Xarelto®(rivaroxabana), em dose de 10 mg uma vez ao dia, iniciada no mínimo 6 horas após a cirurgia, foi comparada a 40 mg de enoxaparina uma vez por dia, iniciada em 12 horas antes da cirurgia.
Em três estudos de fase III (ver Tabela 1), a rivaroxabana reduziu significativamente a taxa de TEV total (qualquer TVP venograficamente detectada ou sintomática, EP não-fatal ou morte) e de TEV maior (TVP proximal, EP não-fatal e morte relacionada ao TEV), os objetivos finais (endpoints) de eficácia primária e secundária maior pré-especificados. Além disso, em todos os três estudos, a taxa de TEV sintomático (TVP sintomática, EP não-fatal, morte relacionada a um TEV) foi mais baixa nos pacientes tratados com Xarelto®(rivaroxabana), em comparação aos pacientes tratados com enoxaparina.
O objetivo final principal de segurança, sangramento maior, mostrou taxas comparáveis para pacientes tratados com 10 mg de Xarelto®(rivaroxabana), em comparação a 40 mg de enoxaparina.
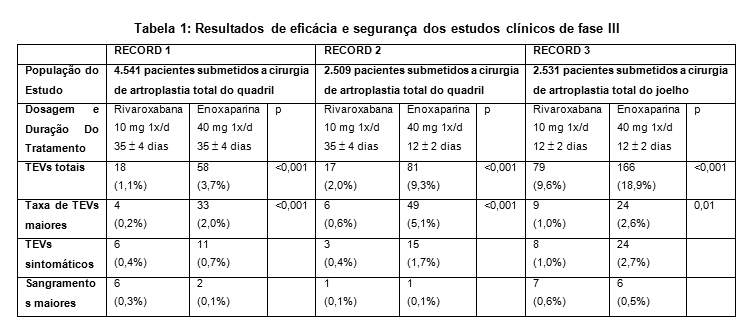
A análise dos resultados agrupados dos ensaios clínicos de fase III corroborou os dados obtidos nos estudos individuais referentes à redução de TEVs totais, de TEVs maiores e de TEVs sintomáticos com 10 mg de Xarelto®(rivaroxabana) uma vez ao dia, em comparação a 40 mg de enoxaparina uma vez ao dia.
Caract. farmacológicas.
• Propriedades farmacodinâmicas
A rivaroxabana é um inibidor direto altamente seletivo do fator Xa com biodisponibilidade oral.
A ativação do fator X a fator Xa (FXa) por meio das vias intrínseca e extrínseca desempenha um papel central na cascata da coagulação sanguínea. O FXa converte diretamente a protrombina em trombina por meio do complexo de protrombinase e, finalmente, esta reação leva à formação do coágulo de fibrina e à ativação das plaquetas pela trombina. Uma molécula de FXa é capaz de gerar mais de 1.000 moléculas de trombina pela natureza de amplificação da cascata da coagulação. Além disso, a taxa de reação do FXa ligado à protrombinase aumenta 300.000 vezes, em comparação à do FXa livre, e causa uma descarga explosiva de geração de trombina. Os inibidores seletivos de FXa podem encerrar a descarga amplificada de geração de trombina. Conseqüentemente, os testes de coagulação específicos e globais são afetados pela rivaroxabana. Foi observada inibição dose-dependente da atividade do fator Xa em humanos.
O tempo de protrombina (TP) é influenciado pela rivaroxabana de um modo dose-dependente com uma correlação estreita com as concentrações plasmáticas (o valor de r é igual a 0,98) se for usado o reagente Neoplastin® (tromboplastina liofilizada obtida a partir de cérebro de coelho) para a realização deste ensaio.
Outros reagentes proporcionariam resultados diferentes. A leitura do TP deve ser feita em segundos porque o CIN (Coeficiente Internacional Normatizado) é calibrado e validado somente para cumarínicos e não pode ser usado para qualquer outro anticoagulante. Em pacientes submetidos a cirurgia ortopédica de grande porte, os percentis 5/95 para TP (Neoplastin®) 2-4 horas depois da ingestão do comprimido (por exemplo, no momento de efeito máximo) variaram de 13 a 25 segundos.
O tempo de tromboplastina parcial ativada (TTPa) e o HepTest® também se prolongam dependendo da dose; entretanto, não são recomendados para avaliar o efeito farmacodinâmico da rivaroxabana. A atividade anti-fator Xa também é influenciada pela rivaroxabana; todavia, não existe padrão para calibração.
Não há necessidade de monitorar os parâmetros de coagulação durante o tratamento com Xarelto® (rivaroxabana).
• Propriedades farmacocinéticas
- Absorção e biodisponibilidade
A biodisponibilidade absoluta da rivaroxabana é alta (80%-100%) para a dose de 10 mg. A rivaroxabana é rapidamente absorvida, atingindo concentrações máximas (Cmáx) 2 a 4 horas após a ingestão do comprimido.
A ingestão com alimentos não afeta a AUC ou a Cmáx de rivaroxabana na dose de 10 mg. A dose de 10 mg de Xarelto® (rivaroxabana) pode ser tomada com ou sem alimento (ver item "Posologia e Modo de Usar").
A variabilidade da farmacocinética da rivaroxabana é moderada, com variabilidade interindividual (CV%) de 30 a 40%, exceto no dia da cirurgia e no dia seguinte, quando a variabilidade na exposição é alta (70%).
- Distribuição
A ligação às proteínas plasmáticas em humanos é alta, aproximadamente de 92% a 95%, sendo a albumina sérica o principal componente de ligação. O volume de distribuição é moderado, sendo Vss de aproximadamente 50 L.
- Metabolismo e eliminação
Da dose administrada de rivaroxabana, aproximadamente 2/3 sofre degradação metabólica, com metade sendo eliminada via renal e a outra metade, via fecal. Os demais 1/3 da dose administrada são diretamente excretados pelos rins como fármaco inalterado na urina, principalmente por secreção renal ativa.
A rivaroxabana é metabolizada por meio de CYP 3A4, CYP 2J2 e de mecanismos independentes do CYP. A degradação oxidativa da parte morfolinona e a hidrólise das ligações amida são os principais locais de biotransformação.
Com base em investigações in vitro, a rivaroxabana é um substrato das proteínas transportadoras P-gp (P-glicoproteína) e Prcm (proteína de resistência ao câncer de mama).
A rivaroxabana inalterada é o composto mais importante no plasma humano, não estando presentes metabólitos maiores ou ativos circulantes. Com uma depuração sistêmica de cerca de 10 L/h, a rivaroxabana pode ser classificada como um fármaco de baixa depuração. A eliminação da rivaroxabana do plasma ocorreu com meias-vidas terminais de 5 a 9 horas em indivíduos jovens e com meias-vidas terminais de 11 a 13 horas em idosos.
- Pacientes geriátricos
Pacientes idosos apresentaram concentrações plasmáticas mais altas que pacientes mais jovens, com valores médios de AUC aproximadamente 1,5 vezes maiores, devido principalmente à redução (aparente) da depuração total e renal (ver item "Posologia e Modo de Usar"). Não há diferenças clinicamente relevantes da farmacocinética entre pacientes homens e mulheres (ver item "Posologia e Modo de Usar").
Populações e condições especiais
- Diferentes categorias de peso
Pesos corpóreos extremos ( < 50 kg vs > 120 kg) tiveram pequena influência nas concentrações plasmáticas de rivaroxabana (menos de 25%) (ver item "Posologia e Modo de Usar").
Dados agrupados obtidos dos estudos clínicos RECORD 1, RECORD 2 e RECORD 3 demonstraram que existe uma tendência a aumento do risco de sangramento em pacientes com peso corpóreo acima de 110kg.
- Crianças e adolescentes
Não existem dados disponíveis para pacientes nesta população (ver item "Posologia e Modo de Usar").
- Diferenças étnicas
Não foram observadas diferenças clinicamente relevantes entre pacientes caucasianos, afro-americanos, hispânicos, japoneses ou chineses em relação à farmacocinética e farmacodinâmica (ver item "Posologia e Modo de Usar").
- Insuficiência hepática
O efeito de insuficiências hepáticas na farmacocinética da rivaroxabana foi estudado em indivíduos categorizados de acordo com a classificação Child Pugh, um procedimento padrão no desenvolvimento clínico. O propósito original da classificação Child Pugh é avaliar o prognóstico da doença hepática crônica, principalmente cirrose. Em pacientes nos quais o uso de anticoagulantes é pretendido, o aspecto crítico da insuficiência hepática é a redução da síntese de fatores de coagulação normais no fígado. Devido ao fato de que este aspecto é considerado em apenas um dos cinco medidores clínicos/bioquímicos que compõem o sistema de classificação Child Pugh, o risco de sangramentos em pacientes pode não ser claramente correlacionado com esta classificação. A decisão de tratar os pacientes com anticoagulantes deve ser, portanto, tomada independentemente da classificação Child Pugh.
Xarelto® (rivaroxabana) é contraindicado em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante.
Pacientes cirróticos com insuficiência hepática leve (classificados como Child Pugh A) apresentaram apenas pequenas alterações na farmacocinética da rivaroxabana (aumento de 1,2 vezes da AUC, em média), próximas das de seu respectivo grupo controle saudável. Nenhuma diferença relevante nas propriedades farmacodinâmicas foi observada entre estes grupos.
Em pacientes cirróticos com insuficiência hepática moderada (classificados como Child Pugh B), a média da AUC de rivaroxabana foi significantemente aumentada em 2,3 vezes comparada com voluntários sadios, devido à importante insuficiência na depuração do fármaco, o que indica uma significante doença hepática. A AUC da fração não-ligada foi aumentada em 2,6 vezes. Não há dados em pacientes com insuficiência hepática grave.
A inibição da atividade do fator Xa foi aumentada por um fator de 2,6 quando comparada a voluntários sadios; o prolongamento TP foi similarmente aumentado por um fator de 2,1. O teste global de coagulação TP avalia a via extrínseca que compreende os fatores de coagulação VII, X, V, II e I que são sintetizados no fígado. Pacientes com insuficiência hepática moderada foram mais sensíveis à rivaroxabana, resultando em uma acentuada relação PK/PD entre concentração e TP.
Não há dados disponíveis para pacientes Child Pugh C (ver item "Posologia e Modo de Usar").
- Insuficiência renal
Houve um aumento na exposição à rivaroxabana inversamente correlacionada com a diminuição da função renal, como avaliado pela medida da depuração de creatinina.
Em indivíduos com insuficiência renal leve (ClCr 80-50 mL/min), moderada (ClCr < 50-30 mL/min) ou grave (ClCr < 30-15 mL/min), as alterações na concentração plasmáticas de rivaroxabana (AUC) foram 1,4; 1,5 e 1,6 vezes maiores, respectivamente, comparadas com voluntários sadios (ver itens "Posologia e Modo de Usar" e "Advertências e Precauções"). Aumentos correspondentes nos efeitos farmacodinâmicos foram mais pronunciados (ver itens "Posologia e Modo de Usar" e "Advertências e Precauções").
Em indivíduos com insuficiência renal leve, moderada ou grave, a inibição total da atividade do fator Xa foi aumentada por um fator 1,5; 1,9 e 2,0, respectivamente quando comparada com voluntários sadios; prolongamento TP foi similarmente aumentado por um fator de 1,3; 2,2 e 2,4, respectivamente. Não há dados em pacientes com ClCr < 15 mL/min.
O uso não é recomendado em pacientes com depuração de creatinina < 15 mL/min. Xarelto® (rivaroxabana) deve ser utilizado com cautela em pacientes com insuficiência renal grave (depuração de creatinina 15-30 mL/min) (ver itens "Posologia e Modo de Usar" e "Advertências e Precauções").
Devido à doença de base, pacientes com insuficiência renal grave apresentam risco aumentado de sangramento e trombose.
• Dados de segurança pré-clínicos
Exceto pelos efeitos relacionados a um modo de ação farmacológico exacerbado (sangramentos), os dados pré-clínicos não revelam prejuízo especial para humanos, com base em estudos de farmacologia de segurança, toxicidade de doses repetidas e genotoxicidade.
A rivaroxabana foi testada para avaliação de segurança não-clínica em estudos convencionais e apropriados de farmacologia de segurança, toxicidade de dose única e de doses repetidas, genotoxicidade, fototoxicidade e toxicidade para a reprodução. Não se observou toxicidade organoespecífica da rivaroxabana até a dose mais alta testada.
- Farmacologia de segurança
As funções cardiovascular, respiratória e do SNC não foram afetadas. Não se observou potencial pró-arrítmico.
Não foram observados efeitos clinicamente revelantes na motilidade gastrintestinal, função hepática, função renal e níveis de glicose sanguínea.
- Toxicidade aguda e de doses repetidas
A rivaroxabana mostrou baixa toxicidade aguda em ratos e camundongos.
A rivaroxabana foi testada em estudos de doses repetidas por até 6 meses em ratos e por até 12 meses em cães. Com base no modo de ação farmacológico, não se pôde estabelecer NOEL (Nível de efeito não observado) em razão dos efeitos sobre o tempo de coagulação. Todos os achados adversos, exceto uma discreta redução do ganho de peso corporal em ratos e cães, não puderam ser relacionados a um modo de ação farmacológico exagerado do composto. Em cães com exposições muito altas, foram observados sangramentos espontâneos graves. Os NOAELs (Níveis de efeitos adversos não observados) depois de exposição crônica são 12,5 mg/kg em ratos e 5 mg/kg em cães.
- Carcinogenicidade
Estudos de mutagenicidade in vitro (ensaio microssomal de Salmonella, ensaio citogenético in vitro com células V9) e ensaios in vivo (Micronúcleo) não revelaram qualquer evidência de potencial genotóxico. Além disso, não se observaram lesões neoplásicas em estudos de toxicidade de dose repetida realizados com ratos, camundongos e cães. Portanto, não foram considerados necessários estudos de carcinogenicidade para apoiar a indicação de uso apenas a curto prazo.
- Toxicologia para a reprodução
A rivaroxabana foi testada em estudos de toxicidade para o desenvolvimento em níveis de exposição de até 38 vezes (rato) e de até 89 vezes (coelho) acima da exposição terapêutica em humanos. O perfil toxicológico se caracteriza principalmente por toxicidade materna causada por efeitos farmacodinâmicos exagerados. Até a dose mais alta testada, não se identificou potencial teratogênico primário (ver item "Gravidez e lactação").
A radioatividade relacionada a [C14] rivaroxabana penetrou na barreira placentária em ratos. Em nenhum dos órgãos e tecidos fetais, a exposição, em termos de concentrações máximas ou AUC, excedeu a exposição sanguínea materna. A exposição média nos fetos, baseada na AUC (0-24), chegou a cerca de 20% da exposição no sangue materno. As glândulas mamárias tinham uma AUC aproximadamente equivalente à do sangue, o que indica secreção de radioatividade no leite (ver item "Gravidez e lactação").
A rivaroxabana não mostrou efeito sobre a fertilidade masculina ou feminina até 200 mg/kg (ver item "Gravidez e lactação").
- Lactação
Administrou-se [C14] rivaroxabana por via oral a ratas Wistar (dia 8 a 10 do pós-parto) em dose oral única de 3 mg/kg de peso corporal.
A radioatividade relacionada a [C14] rivaroxabana foi secretada no leite da ratas lactantes somente num grau baixo em relação à dose administrada: A quantidade estimada de radioatividade excretada com o leite foi de 2,12% da dose materna no prazo de 32 horas depois da administração (ver item "Gravidez e lactação").
- Genotoxicidade
Não se observou genotoxicidade num teste para mutação genética em bactérias (Teste de Ames), num teste in vitro para aberrações cromossômicas ou no teste in vivo do micronúcleo.
Contraindicações.
Xarelto® (rivaroxabana) é contraindicado em pacientes com hipersensibilidade à rivaroxabana ou a qualquer outro componente do produto; em pacientes com sangramento ativo clinicamente significativo (por exemplo, hemorragia intracraniana, hemorragia gastrointestinal); e ainda em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante.
Não existem dados disponíveis em humanos para o uso de Xarelto® (rivaroxabana) em mulheres grávidas. Dados em animais mostram que a rivaroxabana atravessa a barreira placentária. Portanto, o uso de Xarelto® (rivaroxabana) é contraindicado durante toda a gravidez (ver itens "Gravidez e lactação" e "Dados de segurança pré-clínicos").
Não existem dados disponíveis para o uso de Xarelto® (rivaroxabana) em mulheres lactantes. Dados em animais indicam que a rivaroxabana é secretada no leite materno. Portanto, Xarelto® (rivaroxabana) só pode ser administrado depois que for descontinuada a amamentação (ver itens "Gravidez e lactação" e "Dados de segurança pré-clínicos").
Advertências e precauções.
• Risco de sangramento
Xarelto® (rivaroxabana), como outros antitrombóticos, deve ser utilizado com cautela em pacientes com risco aumentado de sangramento, tais como:
- distúrbios hemorrágicos adquiridos ou congênitos;
- hipertensão arterial grave não controlada;
- doença gastrintestinal ulcerativa ativa;
- ulcerações gastrintestinais recentes;
- retinopatia vascular;
- hemorragia intracraniana ou intracerebral recente;
- anormalidades vasculares intraespinais ou intracerebrais;
- logo após cirurgia cerebral, espinhal ou oftalmológica.
Deve-se ter cuidado se os pacientes forem tratados concomitantemente com fármacos que interferem na hemostasia, como os antiinflamatórios não-esteroidais (AINEs), os inibidores da agregação plaquetária ou outros antitrombóticos (ver item "Interações Medicamentosas").
Deve-se considerar tratamento profilático para pacientes com risco de doença ulcerativa gastrointestinal.
Qualquer queda de hemoglobina ou da pressão arterial sem explicação deve levar à investigação de um local com hemorragia.
• Anestesia neuraxial (epidural/espinal)
Quando a anestesia neuraxial (epidural/espinal) ou uma punção espinal é realizada, os pacientes tratados com antitrombóticos para prevenção de complicações tromboembólicas correm risco do desenvolvimento de um hematoma epidural ou espinal que pode resultar em paralisia a longo prazo.
O risco destes eventos é ainda mais aumentado com o uso de cateteres epidurais de demora ou pelo uso concomitante de fármacos que afetem a hemostasia. O risco também pode estar aumentado por punção epidural ou espinal traumática ou repetida.
Os pacientes devem ser frequentemente monitorados para sinais e sintomas de alteração neurológica (por exemplo, hipoestesia ou fraqueza dos membros inferiores, disfunção intestinal ou da bexiga). Se forem observados déficits neurológicos, serão necessários diagnóstico e tratamento urgentes.
O médico deve considerar o benefício em potencial em relação ao risco antes da intervenção neuraxial em pacientes anticoagulados ou que vão ser anticoagulados para tromboprofilaxia.
Um cateter epidural não deve ser retirado antes de 18 horas após a última administração de Xarelto® (rivaroxabana).
Xarelto® (rivaroxabana) deve ser administrado no mínimo 6 horas após a remoção do cateter.
Se ocorrer punção traumática, a administração de Xarelto® (rivaroxabana) deverá ser adiada por 24 horas.
• Insuficiência renal
Xarelto® (rivaroxabana) deve ser utilizado com cautela em pacientes com insuficiência renal moderada (ClCr 30-49 mL/min) que estejam recebendo co-medicações que levam ao aumento da concentração de rivaroxabana no plasma (ver item "Interações Medicamentosas").
Em pacientes com insuficiência renal grave (ClCr < 30 mL/min), os níveis plasmáticos de rivaroxabana podem elevar-se significativamente, o que pode levar a um aumento do risco de hemorragia. Em razão da doença de base, estes pacientes têm um aumento do risco de sangramento e de trombose. Em virtude dos dados clínicos limitados, Xarelto® (rivaroxabana) deve ser usado com cautela nos pacientes com ClCr < 30-15 mL/min.
Não há dados clínicos disponíveis para pacientes com insuficiência renal grave (ClCr < 15 mL/min). Portanto o uso de Xarelto® (rivaroxabana) não é recomendado nestes pacientes (ver itens "Posologia e Modo de Usar" e "Características Farmacológicas").
Após início do tratamento, os pacientes com insuficiência renal grave ou risco aumentado de sangramentos e aqueles que recebem tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores das proteases do HIV devem ser cuidadosamente monitorados quanto a sinais de complicações hemorrágicas. Isto pode ser feito por exame físico regular dos pacientes, observação estreita da drenagem da incisão cirúrgica e dosagens periódicas da hemoglobina.
• Medicação concomitante
Xarelto® (rivaroxabana) não é recomendado em pacientes recebendo tratamento sistêmico concomitante com antimicóticos azólicos (por exemplo, cetoconazol) ou inibidores das proteases do HIV (por exemplo, ritonavir). Estes fármacos são potentes inibidores de CYP 3A4 e de P-gp. Portanto, estes fármacos podem aumentar as concentrações plasmáticas de rivaroxabana até um grau clinicamente relevante, o que pode levar ao aumento no risco de sangramentos (ver item "Interações Medicamentosas").
• Prolongamente QTc
Não foi observado efeito de prolongamento do QTc com o uso de Xarelto® (rivaroxabana).
• Informação sobre os excipientes
Como este medicamento contém lactose, os pacientes com problemas hereditários raros de intolerância à lactose ou à galactose (por exemplo, deficiência de lactase de Lapp ou má absorção de glicose-galactose) não devem tomar Xarelto® (rivaroxabana).
• Gravidez e lactação
Não existem dados disponíveis em humanos sobre o uso de Xarelto® (rivaroxabana) em mulheres grávidas.
Em ratas e coelhas, a rivaroxabana mostrou pronunciada toxicidade materna, com alterações placentárias relacionadas ao seu modo de ação farmacológico (por exemplo, complicações hemorrágicas). Não se identificou potencial teratogênico primário. Dados em animais mostraram pronunciada toxicidade materna de rivaroxabana relacionada ao seu modo de ação farmacológica (por exemplo, complicações hemorrágicas) levando à toxicidade reprodutiva (ver item "Dados de segurança pré-clínicos"). Devido ao risco intrínseco de sangramentos e a evidência que Xarelto® (rivaroxabana) atravessa a placenta, seu uso na gravidez é contraindicado (ver itens "ContraIndicações" e "Dados de segurança pré-clínicos").
Não existem dados disponíveis em humanos sobre o uso de Xarelto® (rivaroxabana) em lactantes. Em ratas, a rivaroxabana é secretada no leite. Portanto, Xarelto® (rivaroxabana) só pode ser administrado depois de descontinuada a amamentação (ver itens "Contraindicações" e "Dados de segurança pré-clínicos").
• Mulheres em idade fértil
Xarelto® (rivaroxabana) deve ser utilizado em mulheres em idade fértil somente com um método contraceptivo eficaz.
• Efeito sobre a capacidade de dirigir veículos ou operar máquinas
Não se relatou nenhum efeito de Xarelto® (rivaroxabana) sobre a capacidade de dirigir veículos ou de operar máquinas.
Interações medicamentosas.
• Interações farmacocinéticas
A rivaroxabana é eliminada principalmente pelo metabolismo hepático mediado pelo citocromo P450 (CYP 3A4, CYP 2J2) e por excreção renal do fármaco inalterado, envolvendo sistemas de transportadores P-glicoproteína (P-gp) / proteína de resistência ao câncer de mama (prcm).
• Inibição do CYP
A rivaroxabana não inibe o CYP 3A4 nem qualquer outra isoforma principal de CYP.
• Indução do CYP
A rivaroxabana não induz o CYP 3A4 nem qualquer outra isoforma principal de CYP.
• Efeitos da rivaroxabana
O uso concomitante de Xarelto® (rivaroxabana) com inibidores potentes do CYP 3A4 e inibidores de P-gp pode levar à redução da depuração hepática e renal e, deste modo, a aumento significativo da exposição sistêmica.
A co-administração de Xarelto® (rivaroxabana) com cetoconazol, antimicótico azólico (400 mg uma vez ao dia), um potente inibidor do CYP3A4 e do P-gp, levou a um aumento de 2,6 vezes da AUC média da rivaroxabana no estado de equilíbrio e um aumento de 1,7 vezes da Cmáx média de rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos.
A co-administração de Xarelto® (rivaroxabana) com o inibidor de protease do HIV, ritonavir (600 mg duas vezes ao dia), um potente inibidor de CYP 3A4 e de P-gp, levou a um aumento de 2,5 vezes da AUC média da rivaroxabana e a um aumento de 1,6 vezes de Cmáx média de rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos. Portanto, Xarelto® (rivaroxabana) não é recomendado em pacientes que estejam recebendo tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores de proteases do HIV (ver item "Advertências e Precauções").
Para outros fármacos que inibam potentemente apenas uma das vias de eliminação de rivaroxabana, seja CYP 3A4 ou P-gp, é esperado que o aumento das concentrações plasmáticas de rivaroxabana seja de menor extensão.
A claritromicina (500 mg, duas vezes ao dia), considerada um potente inibidor da CYP 3A4 e inibidor moderado da P-gp, levou ao aumento de 1,5 vezes da AUC média de rivaroxabana e de 1,4 vezes da Cmáx. Este aumento, que está próximo à magnitude da variabilidade normal da AUC e Cmáx, é considerado clinicamente irrelevante.
A eritromicina (500 mg três vezes ao dia), que inibe moderadamente CYP 3A4 e P-gp, levou a um aumento de 1,3 vezes da AUC e da Cmáx média da rivaroxabana. Este aumento está dentro da magnitude de variabilidade normal de AUC e Cmáx e é considerado clinicamente irrelevante.
A co-administração de Xarelto® (rivaroxabana) com o indutor potente de CYP 3A4 e de P-gp, rifampicina, levou a uma diminuição aproximada de 50% da AUC média da rivaroxabana, havendo diminuições paralelas em seus efeitos farmacodinâmicos.
O uso concomitante de Xarelto® (rivaroxabana) com outros indutores potentes do CYP 3A4 (por exemplo, fenitoína, carbamazepina, fenobarbital ou Erva de São João) também pode levar a uma diminuição da concentração plasmática de rivaroxabana. A diminuição das concentrações plasmáticas de rivaroxabana é considerada clinicamente irrelevante.
• Interações farmacodinâmicas
Após administração combinada de enoxaparina (40 mg em dose única) com Xarelto® (rivaroxabana) (10 mg em dose única), foi observado um fator aditivo sobre a atividade anti fator Xa sem qualquer efeito adicional sobre os testes de coagulação (TP, TTPa). A enoxaparina não afetou a farmacocinética da rivaroxabana (ver item "Advertências e Precauções").
O clopidogrel (300 mg em dose de ataque, seguida por 75 mg de dose de manutenção) não mostrou uma interação farmacocinética, mas foi observado um aumento relevante dos tempos de sangramento num subgrupo de pacientes, e esse efeito não se correlacionou à agregação plaquetária, à P-selectina ou aos níveis de receptores de GPIIb/IIIa (ver item "Advertências e Precauções").
Não foi observado prolongamento clinicamente relevante do tempo de sangramento após administração concomitante de Xarelto® (rivaroxabana) e 500 mg de naproxeno. Todavia, pode haver indivíduos com resposta farmacodinâmica mais pronunciada (ver item "Advertências e Precauções").
• Alimentos e laticínios
A dose de 10 mg de Xarelto® (rivaroxabana) pode ser tomada com ou sem alimentos (ver item "Características Farmacológicas")
• Interações cuja existência não foi demonstrada
Não houve interações farmacocinéticas mútuas entre rivaroxabana e midazolam (substrato de CYP 3A4), digoxina (substrato de P-glicoproteína) ou atorvastatina (substrato de CYP 3A4 e P-gp).
A co-administração do antagonista do receptor H2 ranitidina, o antiácido hidróxido de alumínio / hidróxido de magnésio, naproxeno, clopidogrel ou enoxaparina não afetou a biodisponibilidade e a farmacocinética da rivaroxabana.
Não foram observadas interações farmacocinéticas ou farmacodinâmicas clinicamente significativas quando Xarelto® (rivaroxabana) foi co-administrado com 500 mg de ácido acetilsalicílico.
• Interações com parâmetros laboratoriais
Os testes de parâmetros da coagulação (TP, TTPa, Teste Hep®) são afetados como esperado pelo modo de ação de Xarelto® (rivaroxabana).
• Interações com tabaco e álcool
Não foi realizado estudo formal sobre a interação com tabaco ou ácool, uma vez que interação farmacocinética não é prevista. Durante os estudos de fase I, não era permitido o consumo de álcool pelos pacientes.
Durante a fase ambulatorial, era permitido o consumo de álcool pelos pacientes em doses de até 40 g por dia. Era permitido fumar durante o ensaio.
Nos estudos de fase III (RECORD 1, 2 e 3) não houve restrição quanto ao consumo de tabaco. O abuso de álcool foi um critério de exclusão em todos os estudos de fase III, mas não foram utilizadas restrições adicionais nos ensaios.
Cerca de 50% dos 4657 pacientes no grupo da rivaroxabana submetidos à artroplastia de joelho ou quadril nos estudos de fase III relataram em seu histórico médico o consumo de álcool ao menos eventualmente. Pacientes foram ambulatoriais durante algum tempo, mas não há disponível nenhuma informação adicional sobre o uso concomitante de álcool e tabaco.
Cuidados de armazenamento.
Xarelto® (rivaroxabana) deve ser conservado em temperatura ambiente (entre 15°C e 30°C).
O prazo de validade do medicamento é de 36 meses a partir da data de fabricação.
"Número de lote e datas de fabricação e validade: vide embalagem."
"Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original."
Xarelto® (rivaroxabana) é um comprimido redondo vermelho claro.
"Antes de usar, observe o aspecto do medicamento."
"Todo medicamento deve ser mantido fora do alcance das crianças."
Posologia e modo de usar.
A dose recomendada para prevenção de TEV em cirurgia ortopédica é um comprimido de 10 mg uma vez ao dia, com ou sem alimento.
A duração do tratamento depende do tipo de cirurgia ortopédica.
Após cirurgia de grande porte do quadril, os pacientes devem ser tratados por 5 semanas.
Após cirurgia de grande porte do joelho, os pacientes devem ser tratados por 2 semanas.
A dose inicial deve ser tomada 6 a10 horas após a cirurgia, contanto que tenha sido estabelecida a hemostasia.
Em caso de esquecimento da tomada de um comprimido, o paciente deverá tomá-lo assim que se lembrar e, no dia seguinte, continuar tomando o comprimido uma vez ao dia, como antes.
• Informações adicionais sobre populações especiais
- Crianças e adolescentes
Não existem dados clínicos para crianças.
- Pacientes geriátricos
Não é necessário ajuste de dose para estas populações de pacientes (ver item "Características Farmacológicas").
- Gênero
Não é necessário ajuste de dose com base no sexo do paciente (ver item "Características Farmacológicas").
- Peso corporal
Não é necessário ajuste de dose para o peso corporal do paciente (ver item "Características Farmacológicas").
- Pacientes com insuficiência hepática
Xarelto® (rivaroxabana) é contraindicado em pacientes com doença hepática associada à coagulopatia, levando a um risco de sangramento clinicamente relevante.
Não é necessário ajuste de dose em pacientes com outras doenças hepáticas (ver item "Características Farmacológicas").
Dados clínicos limitados em pacientes com insuficiência hepática moderada (Child Pugh B) indicam aumento significativo da atividade farmacológica. Não existem dados clínicos disponíveis para pacientes com insuficiência hepática grave (Child Pugh C) (ver itens "Contraindicações" e "Características Farmacológicas").
- Pacientes com insuficiência renal
Não é necessário ajuste de dose se a rivaroxabana for administrada em pacientes com insuficiência renal leve (depuração de creatinina ClCr 80-50 mL/min) ou moderada (ClCr < 50-30 mL/min) (ver item "Características Farmacológicas").
Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr < 30-15 mL/min) indicam que os níveis plasmáticos de rivaroxabana aumentam significativamente nesta população de pacientes. Portanto, Xarelto® (rivaroxabana) deve ser utilizado com cautela nestes pacientes.
O uso de Xarelto® (rivaroxabana) não é recomendado para pacientes com ClCr < 15 mL/min (ver itens "Advertências e Precauções" e "Características Farmacológicas").
- Diferenças étnicas
Não é necessário ajuste de dose com base em diferenças étnicas (ver item "Características Farmacológicas").
"Este medicamento não deve ser partido, aberto ou mastigado."
Reações adversas.
A segurança de Xarelto® (rivaroxabana) 10 mg foi avaliada em quatro estudos de fase III que incluíram 6097 pacientes expostos ao Xarelto® (rivaroxabana), submetidos a uma cirurgia ortopédica de grande porte nos membros inferiores (artroplastia total do quadril ou do joelho) tratados por até 39 dias. No total de cerca de 14% dos pacientes tratados apresentaram reações adversas. Sangramentos ocorreram em aproximadamente 3% e anemia, em aproximadamente 1% dos pacientes. Outras reações adversas comuns são náusea, aumento da GGT e aumento nas transaminases. As reações adversas são apresentadas dentro de cada grupo de frequência por classe do sistema de órgãos; as reações adversas devem ser interpretadas dentro do ambiente cirúrgico.
Em razão do modo de ação farmacológico, Xarelto® (rivaroxabana) pode ser associado a um risco aumentado de sangramento oculto ou manifesto em qualquer tecido ou órgão, o que pode resultar em anemia pós-hemorrágica. Os sinais, sintomas e gravidade (incluindo possível resultado fatal) variam de acordo com a localização e o grau ou extensão do sangramento e/ou anemia. O risco de sangramentos pode ser aumentado em certos grupos de pacientes, por exemplo, naqueles com hipertensão arterial grave não-controlada e/ou com medicação concomitante que afete a homeostase (ver item "Advertências e Precauções"). Podem estar presentes complicações hemorrágicas como fraqueza, palidez, tontura, cefaléia ou edema inexplicável, dispneia e choque inexplicado. Em alguns casos, como consequência da anemia, podem ocorrer sintomas de isquemia cardíaca, tais como dor no peito ou angina pectoris. Portanto, deve-se considerar a possibilidade de uma hemorragia ao avaliar as condições de qualquer paciente anticoagulado.
As frequências das reações adversas relatadas com Xarelto® (rivaroxabana) estão resumidas na tabela abaixo. As reações adversas estão apresentadas em ordem decrescente de gravidade dentro de cada grupo de frequência, que são definidas como frequente (≥ 1/100 a < 1/10), pouco frequente (≥ 1/1.000 a < 1/100) e rara (≥ 1/10.000 a < 1/1.000). As reações adversas identificadas apenas durante o período de observação pós-comercialização, para as quais a frequência não pôde ser estimada, estão listadas como "frequência desconhecida".
Todas as reações adversas emergentes ao tratamento relacionadas ao medicamento relatadas em pacientes nos estudos RECORD 1-4 estão listadas abaixo.
Distúrbios sanguíneos e do sistema linfático
• Anemia (incluindo os respectivos parâmetros laboratoriais) e trombocitemia (incluindo aumento da contagem de plaquetas) foram pouco frequentes.
Distúrbios cardíacos
• Taquicardia foi pouco frequente.
Distúrbios gastrintestinais
• Náuseas foram frequentes.
• Constipação, diarréia, dor abdominal e gastrintestinal (incluindo dor no abdôme superior e desconforto gástrico), dispepsia (incluindo desconforto epigástrico), boca seca e vômitos foram pouco frequentes.
Distúrbios gerais e condições no local de administração
• Febre e edema periférico foram frequentes
• Edema localizado, diminuição geral da força e energia (incluindo fadiga e astenia) foram pouco frequentes
• Indisposição (incluindo mal-estar) foi rara.
Distúrbios hepatobiliares
• Função hepática anormal foi rara.
Distúrbios do sistema imune
• Dermatite alérgica foi rara.
• Traumas, intoxicações e complicações do procedimento
Hemorragia pós-procedimento (incluindo anemia pós-operatória e hemorragia da incisão) foi frequente.
• Secreção nas incisões foi pouco frequente.
Investigações
Aumento de GGT e aumento das transaminases (incluindo aumento de ALT e de AST) foram frequentes.
Aumento da lipase, aumento da amilase, aumento da bilirrubina, aumento de DHL e aumento de fosfatase alcalina foram pouco frequentes.
Aumento da bilirrubina conjugada (com ou sem aumento concomitante de ALT) foi rara.
Distúrbios músculo-esqueléticos, do tecido conjuntivo e dos ossos
• Dor nas extremidades foi pouco frequente.
Distúrbios do sistema nervoso
• Tontura e cefaléia foram pouco frequentes.
• Síncope (incluindo perda de consciência) foi rara.
Distúrbios renais e urinários
• Alteração renal (incluindo aumento da creatinina e da uréia no sangue) foi pouco frequente.
Distúrbios da pele e do tecido subcutâneo
• Prurido (incluindo casos raros de prurido generalizado), rash cutâneo e contusão foram pouco frequentes.
• Urticária (incluindo casos raros de urticária generalizada) foi rara.
Distúrbios vasculares
• Hipotensão (incluindo diminuição da pressão arterial e hipotensão pelo procedimento), hemorragia, hematoma (incluindo casos raros de hemorragia muscular), hemorragia no trato gastrintestinal (incluindo sangramento gengival, hemorragia retal, hematêmese), hemorragia do trato urogenital e epistaxe foram pouco frequentes.
Em outros estudos clínicos com rivaroxabana, foram relatados casos isolados de hemorragia da adrenal e hemorragia conjuntival, além de hemorragia fatal em úlcera gastrintestinal; foram raros os casos de icterícia e de hipersensibilidade, e hemoptise foi pouco frequente. Foram reportados sangramentos intracraniais (especialmente em pacientes com hi
pertensão arterial e/ou sob agentes antihemostáticos concomitantemente) que em casos isolados podem ser potencialmente fatais.
Em outros estudos clínicos foi relatado formação de pseudoaneurisma vascular seguido de intervenção percutânea.
Além disso, em outros estudos clínicos e de observação pós-comercialização, foram relatados complicações secundárias conhecidas ao sangramento, tais como síndrome do compartimento.Insuficiência renal aguda/insuficiência renal secundária a um evento de sangramento suficiente para causar hipoperfusão também foram relatados.
"Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em www.anvisa.gov.br, ou para a Vigilância Sanitária Estadual ou Municipal."
Superdose.
A superdosagem após a administração de Xarelto®(rivaroxabana) pode levar a complicações hemorrágicas devido a suas propriedades farmacodinâmicas.
Não está disponível um antídoto específico para antagonizar os efeitos farmacológicos da rivaroxabana.
Pode-se considerar o uso de carvão ativado para reduzir a absorção no caso de superdosagem de Xarelto®(rivaroxabana). A administração de carvão ativado até 8 horas após a superdosagem pode reduzir a absorção de rivaroxabana.
Devido à alta ligação da rivaroxabana às proteínas plasmáticas, não se espera que esta seja dialisável.
Caso ocorra sangramento, o controle da hemorragia pode incluir as seguintes etapas:
- Atraso da administração seguinte de Xarelto®(rivaroxabana) ou descontinuação do tratamento, conforme apropriado. A rivaroxabana tem meia-vida de aproximadamente 5 a 13 horas (ver item "Características Farmacológicas").
- Deve ser considerado o tratamento sintomático apropriado, por exemplo, compressão mecânica (como na epistaxe grave), intervenções cirúrgicas, reposição de líquidos e suporte hemodinâmico, transfusão de hemoderivados ou componentes.
Se o sangramento não puder ser controlado pelas medidas mencionadas acima, pode-se considerar a administração de um dos seguintes procoagulantes:
- concentrado de complexo de protrombina ativada (CCPA);
- concentrado de complexo de protrombina (CCP);
- fator VIIa recombinante (rF VIIa).
No entanto, atualmente não há experiência com o uso destes produtos em pacientes recebendo Xarelto®(rivaroxabana).
Não se espera que o sulfato de protamina e a vitamina K afetem a atividade anticoagulante da rivaroxabana.
Não há fundamentação científica de benefício ou experiência com hemostáticos sistêmicos (por exemplo, desmopressina, aprotinina, ácido tranexâmico, ácido aminocapróico) em indivíduos que estejam recebendo Xarelto® (rivaroxabana).
"Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações."
Dizeres legais.
MS - 1.7056.0048
Venda sob prescrição médica
XARELTO®
BAYER
15mg e 20mg
rivaroxabana
Antitrombótico.
Apresentações.
Xarelto® (rivaroxabana) é apresentado na forma de comprimidos revestidos em cartucho com blíster contendo 14 ou 28 comprimidos revestidos de 15 mg ou 20 mg.
USO ORAL
USO ADULTO
Composição.
Cada comprimido revestido contém 15 mg ou 20 mg de rivaroxabana. Excipientes: celulose microcristalina, croscarmelose sódica, hipromelose, lactose monoidratada, estearato de magnésio, laurilsulfato de sódio, óxido férrico vermelho, macrogol, dióxido de titânio.
Indicações.
Xarelto® (rivaroxabana) é indicado para prevenção de acidente vascular cerebral e embolia sistêmica em pacientes adultos com fibrilação atrial não-valvular que apresente um ou mais fatores de risco, como insuficiência cardíaca congestiva, hipertensão, 75 anos de idade ou mais, diabetes mellitus, acidente vascular cerebral ou ataque isquêmico transitório anteriores.
Xarelto® (rivaroxabana) é indicado para o tratamento de trombose venosa profunda (TVP) e prevenção de trombose venosa profunda (TVP) e embolia pulmonar (EP) recorrentes após trombose venosa profunda aguda, em adultos.
Xarelto® (rivaroxabana) é indicado para o tratamento de embolia pulmonar (EP) e prevenção de embolia pulmonar (EP) e trombose venosa profunda (TVP) recorrentes, em adultos.
Resultados de eficácia.
• Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular
O programa clínico de Xarelto® (rivaroxabana) foi desenhado para demonstrar a eficácia de Xarelto® (rivaroxabana) para a prevenção de AVC e embolia sistêmica em pacientes com fibrilação atrial não-valvular (FA).
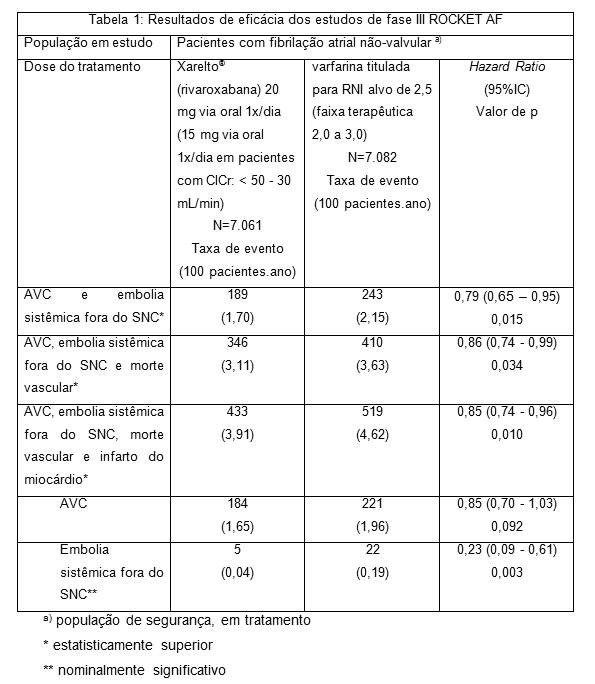
No estudo pivotal duplo-cego ROCKET AF, 14.264 pacientes receberam 20 mg de Xarelto® (rivaroxabana) via oral uma vez ao dia (15 mg via oral uma vez ao dia em pacientes com insuficiência renal moderada (ClCr: < 50-30 mL/min)) ou varfarina titulada tendo como alvo RNI de 2,5 (faixa terapêutica 2,0 a 3,0). O tempo médio em tratamento foi 19 meses e a duração total do tratamento foi de até 41 meses.
34,9% dos pacientes estavam usando ácido acetilsalicílico e 11,4% antiarrítmicos classe III incluindo amiodarona.
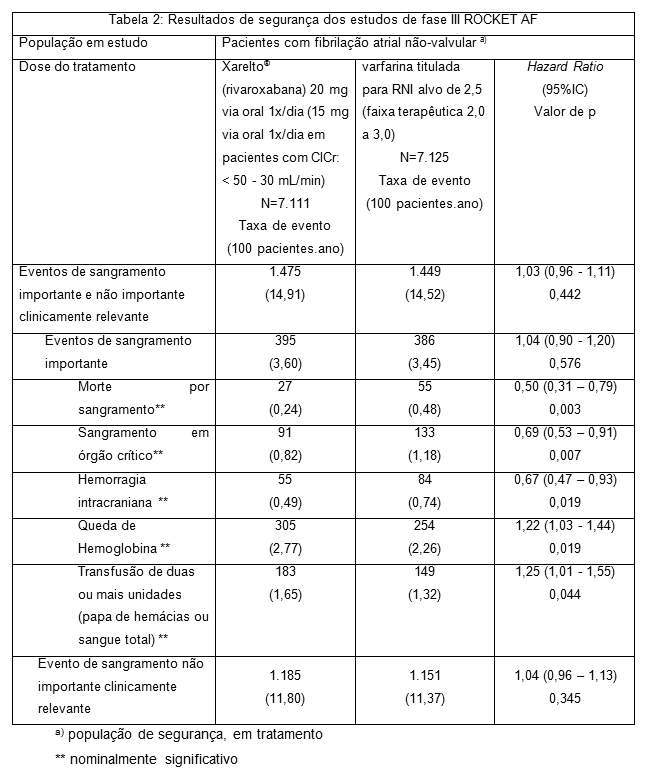
Em relação à varfarina, Xarelto® (rivaroxabana) reduziu significativamente o desfecho primário combinado de AVC e embolia sistêmica fora do SNC. Adicionalmente, desfechos secundários importantes (combinação de acidente vascular cerebral, embolia sistêmica fora do SNC e morte vascular e a combinação de AVC, embolia sistêmica fora do SNC, infarto do miocárdio e morte vascular) também foram reduzidos de forma significativa (veja Tabela 1). As taxas de incidência para o desfecho de segurança principal (eventos de sangramento importante e não importante clinicamente relevante) foram semelhantes nos dois grupos de tratamento (veja Tabela 2).
• Tratamento de trombose venosa profunda (TVP) e embolia pumonar (EP) e prevenção de trombose venosa profunda (TVP) e embolia pulmonar (EP) recorrentes
O programa clínico de Xarelto® (rivaroxabana) foi desenhado para demonstrar a eficácia do medicamento no tratamento inicial e continuado de trombose venosa profunda (TVP) aguda e embolia pulmonar (EP) e na prevenção de TVP e de embolia pulmonar (EP) recorrentes.
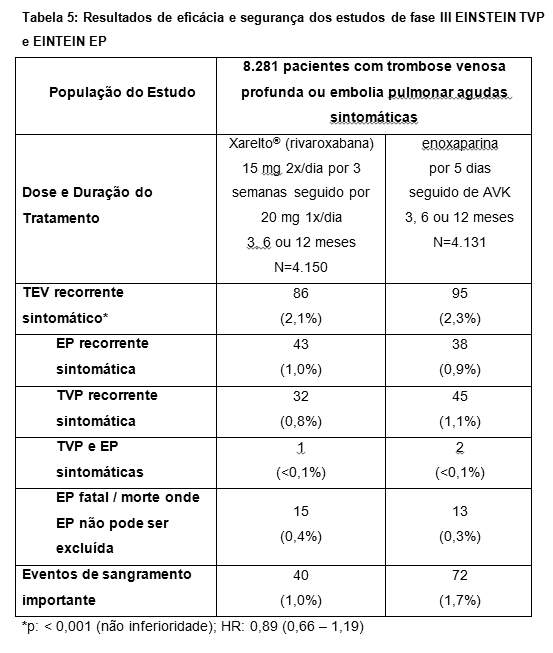
Mais de 9.400 pacientes foram estudados em três ensaios clínicos de fase III, randomizados, controlados (EINSTEIN TVP, EINSTEIN EP e EINSTEIN Extensão) e adicionalmente uma análise predefinida dos estudos Einstein TVP e Einstein EP agrupados foi conduzida (veja Tabela 6). A duração total do tratamento combinado em todos os estudos foi de até 21 meses.
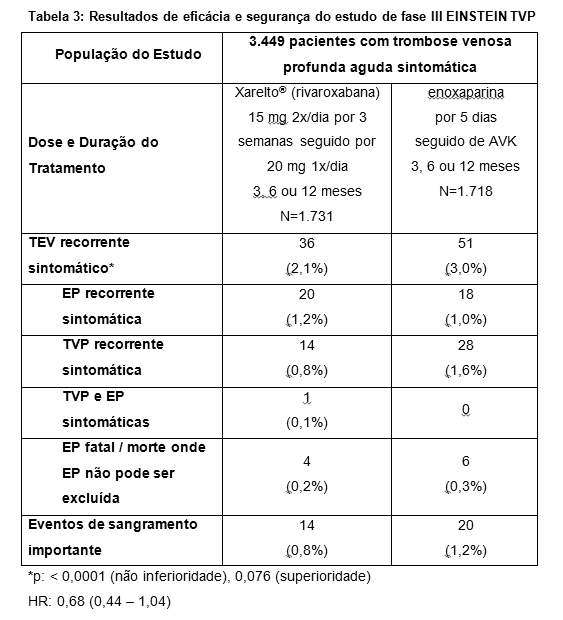
No estudo EINSTEIN TVP, 3.449 pacientes com TVP aguda foram estudados para o tratamento de TVP e prevenção de TVP e de EP recorrentes. A duração do tratamento foi de até 12 meses dependendo do julgamento clínico do investigador.
Para as três semanas iniciais de tratamento da TVP aguda, uma dose de 15 mg de Xarelto® (rivaroxabana) foi administrada duas vezes ao dia. Isto foi seguido por uma dose de 20 mg de Xarelto® (rivaroxabana) uma vez ao dia.
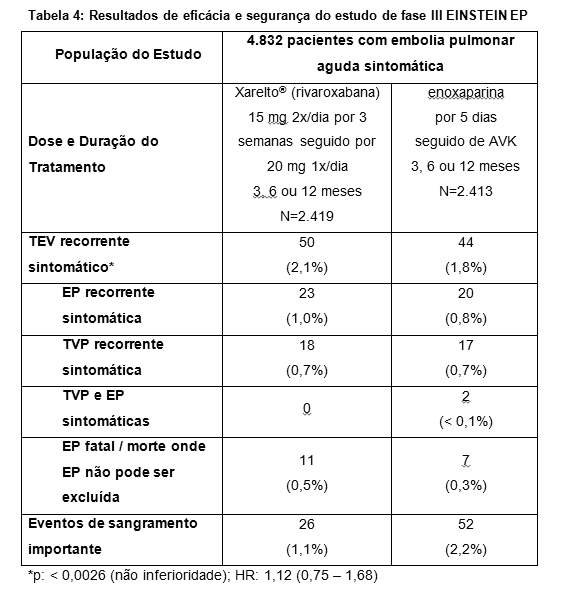
No estudo EINSTEIN EP, 4.832 pacientes com EP aguda foram estudados para o tratamento de EP e prevenção de TVP e EP recorrentes. A duração do tratamento foi de até 12 meses dependendo do julgamento clínico do investigador.
Para o tratamento inicial de EP aguda, uma dose de 15 mg de rivaroxabana foi administrada duas vezes ao dia por três semanas. Isso foi seguido por uma dose de 20 mg de rivaroxabana uma vez ao dia.
Em ambos os estudos EINSTEIN TVP e EINSTEIN EP, o regime de tratamento comparador consistiu em administrar enoxaparina por pelo menos cinco dias em combinação com antagonista da vitamina K até que o valor de TP/RNI atingisse a faixa terapêutica (³ 2,0). O tratamento foi continuado com o antagonista da vitamina K com dose ajustada para manter os valores de TP/RNI dentro da faixa terapêutica de 2,0 a 3,0.
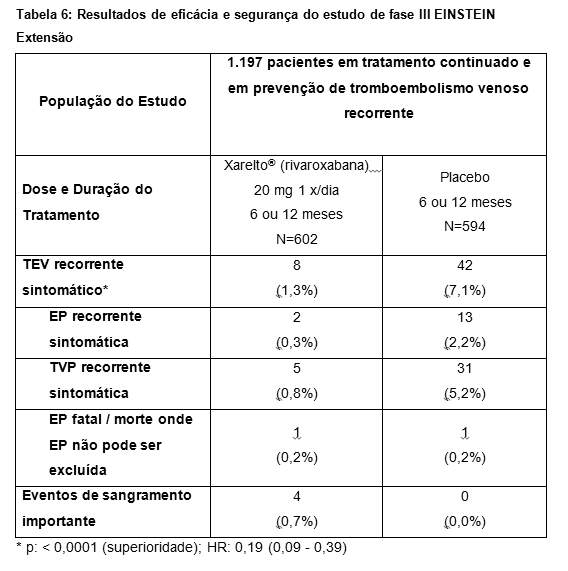
No estudo EINSTEIN Extensão, 1.197 pacientes com TVP ou EP foram estudados para a prevenção de TVP e de EP recorrentes. A duração do tratamento foi de até 12 meses, dependendo do julgamento clínico do investigador. Xarelto® (rivaroxabana) 20 mg uma vez ao dia foi comparado com placebo.
Todos os três estudos de fase III EINSTEIN usaram os mesmos desfechos primário e secundário de eficácia predefinidos. O desfecho primário de eficácia foi TVP sintomática recorrente definido como um composto de TVP recorrente ou EP fatal ou não fatal. O desfecho secundário de eficácia foi definido como um composto de TVP recorrente, EP não fatal e todas as causas de mortalidade.
No estudo EINSTEIN TVP (veja Tabela 3), Xarelto® (rivaroxabana) demonstrou ser não inferior a enoxaparina/AVK para o resultado primário.
O benefício clínico global (NCB - Net Clinical Benefit) predeterminado (desfecho primário de eficácia e eventos de sangramento importante) foi reportado com HR de 0,67 ((IC 95% = 0,47 - 0,95), p = 0,027) a favor da rivaroxabana.
As taxas de incidência para o desfecho principal de segurança (eventos de sangramento importante ou não importante clinicamente relevante) assim como o desfecho secundário de segurança (eventos de sangramento importante), foram semelhantes para ambos os grupos de tratamento.
No estudo EINSTEIN EP (veja Tabela 4) Xarelto® (rivaroxabana) demonstrou ser não inferior a enoxaparina / AVK para o resultado primário (p= 0,0026 (teste para não-inferioridade); hazard ratio: 1,12 (0,75 - 1,68)).
O benefício clínico global pré-especificado (resultado primário de eficácia e eventos de sangramento importante) foi reportado com um HR de 0,85 ((IC 95% = 0,63 - 1,14), valor nominal p= 0,275)).
Foi conduzida uma análise agrupada pré-especificada do resultado dos estudos EINSTEIN TVP e EINSTEIN EP (veja Tabela 5).
No estudo EINSTEIN Extensão (veja Tabela 6), Xarelto® (rivaroxabana) foi superior ao placebo para os resultados primário e secundário de eficácia. Para o desfecho principal de segurança (eventos de sangramento importante) houve uma taxa de incidência mais alta, numericamente não significativa para pacientes tratados com Xarelto® (rivaroxabana) 20 mg uma vez ao dia comparado com placebo. O desfecho de segurança secundário (eventos de sangramento importante ou não importante clinicamente relevante) demonstrou taxas mais altas para pacientes tratados com Xarelto® (rivaroxabana) 20 mg uma vez ao dia comparado com placebo.
Caract. farmacológicas.
• Propriedades farmacodinâmicas
A rivaroxabana é um inibidor direto altamente seletivo do fator Xa com biodisponibilidade oral.
A ativação do fator X a fator Xa (FXa) por meio das vias intrínseca e extrínseca desempenha um papel central na cascata da coagulação sanguínea. O FXa converte diretamente a protrombina em trombina por meio do complexo de protrombinase e, finalmente, esta reação leva à formação do coágulo de fibrina e à ativação das plaquetas pela trombina. Uma molécula de FXa é capaz de gerar mais de 1.000 moléculas de trombina devido à natural amplificação da cascata da coagulação. Além disso, a taxa de reação do FXa ligado à protrombinase aumenta 300.000 vezes em comparação à do FXa livre, e causa uma descarga explosiva de geração de trombina. Os inibidores seletivos de FXa podem encerrar a descarga amplificada de geração de trombina. Consequentemente, diversos testes de coagulação específicos e globais são afetados pela rivaroxabana. Foi observada inibição dose-dependente da atividade do fator Xa em humanos.
O tempo de protrombina (TP) é influenciado pela rivaroxabana de um modo dose-dependente com uma correlação estreita com as concentrações plasmáticas (o valor de r é igual a 0,98) se for usado o reagente Neoplastin® (tromboplastina liofilizada obtida a partir de cérebro de coelho) para a realização deste ensaio.
Outros reagentes proporcionariam resultados diferentes. A leitura do TP deve ser feita em segundos porque a RNI (Relação Normatizada Internacional) é calibrada e validada somente para cumarínicos e não pode ser usada para qualquer outro anticoagulante.
Em pacientes recebendo rivaroxabana para tratamento de TVP e EP e prevenção de TVP e de EP recorrentes, os valores correspondentes aos percentis 5/95 para TP (Neoplastin®) 2 - 4 horas depois da ingestão do comprimido (ou seja, no momento de efeito máximo) variaram de 17 a 32 segundos para 15 mg duas vezes ao dia ou de 15 a 30 segundos para 20 mg uma vez ao dia, respectivamente.
Em pacientes com fibrilação atrial não valvular recebendo rivaroxabana para a prevenção de AVC e embolia sistêmica, os percentis 5/95 para TP (Neoplastin®) 1 - 4 horas após a ingestão do comprimido (ou seja, no momento de efeito máximo) variaram de 14 a 40 segundos em pacientes tratados com 20 mg uma vez ao dia e de 10 a 50 segundos em pacientes com insuficiência renal moderada tratados com 15 mg uma vez ao dia.
O tempo de tromboplastina parcial ativada (TTPa) e o HepTest® também se prolongam dependendo da dose; entretanto, não são recomendados para avaliar o efeito farmacodinâmico da rivaroxabana. A atividade anti-fator Xa também é influenciada pela rivaroxabana; todavia, não existe padrão para calibração.
Não há necessidade de monitorar os parâmetros de coagulação durante o tratamento com Xarelto® (rivaroxabana).
• Propriedades farmacocinéticas
- Absorção e biodisponibilidade
A rivaroxabana é rapidamente absorvida, atingindo concentrações máximas (Cmáx) 2 a 4 horas após a ingestão do comprimido.
A absorção oral da rivaroxabana é quase completa e a biodisponibilidade oral é alta (80-100%) para a dose de 10 mg, independentemente das condições de jejum/alimentação. A ingestão com alimentos não afeta a AUC ou a Cmáx da rivaroxabana na dose de 10 mg. A dose de 10 mg de Xarelto® (rivaroxabana) pode ser tomada com ou sem alimento (ver "Posologia e Modo de Usar").
Devido ao grau reduzido de absorção, uma biodisponibilidade oral de 66% foi determinada para o comprimido de 20 mg sob condições de jejum. Quando Xarelto® (rivaroxabana) 20 mg comprimidos é tomado junto com alimentos, aumentos na AUC média ao redor de 39% foram observados quando comparados a ingestão sob condições de jejum, indicando absorção quase completa e biodisponibilidade oral alta. Xarelto® (rivaroxabana) 15 mg e 20 mg devem ser tomados com alimentos (ver "Posologia e Modo de Usar").
Sob condições de alimentação Xarelto® (rivaroxabana) 10 mg, 15 mg e 20 mg comprimidos demonstraram proporcionalidade de dose.
A variabilidade da farmacocinética da rivaroxabana é moderada, com variabilidade interindividual (CV%) de 30 a 40%.
A absorção da rivaroxabana é dependente do local de liberação do princípio ativo no trato gastrintestinal. Foi relatada uma diminuição de 29% e 56% na AUC e Cmáx quando o granulado de rivaroxabana é liberado no intestino delgado proximal em comparação com o comprimido. A exposição é ainda mais reduzida quando o princípio ativo é liberado no intestino delgado distal, ou no cólon ascendente. Deve-se evitar a administração da rivaroxabana distante ao estômago que pode resultar em redução da absorção e da exposição ao princípio ativo.
A biodisponibilidade (AUC e Cmáx) foi comparável entre 20 mg de rivaroxabana administrados por via oral como comprimido triturado misturado a purê de maçã, ou em suspensão de água e administrada por sonda gástrica seguido por uma refeição líquida, e um comprimido inteiro. Como o perfil farmacocinético da rivaroxabana é previsível e dose-proporcional, os resultados de biodisponibilidade desse estudo são provavelmente aplicáveis para as doses mais baixas de rivaroxabana.
- Distribuição
A ligação às proteínas plasmáticas em humanos é alta, aproximadamente de 92% a 95%, sendo a albumina sérica o principal componente de ligação. O volume de distribuição é moderado, sendo Vss de aproximadamente 50 L.
- Metabolismo e eliminação
Da dose administrada de rivaroxabana, aproximadamente 2/3 sofrem degradação metabólica, com metade sendo eliminada via renal e a outra metade, via fecal. Os demais 1/3 da dose administrada são diretamente excretados pelos rins como fármaco inalterado na urina, principalmente por secreção renal ativa.
A rivaroxabana é metabolizada por meio de CYP 3A4, CYP 2J2 e de mecanismos independentes do CYP. A degradação oxidativa de metade de morfolinona e a hidrólise das ligações amida são os principais locais de biotransformação.
Com base em investigações in vitro, a rivaroxabana é um substrato das proteínas transportadoras gp-P (glicoproteína-P) e Bcrp (proteína de resistência ao câncer de mama).
A rivaroxabana inalterada é o composto mais importante no plasma humano, não estando presentes metabólitos maiores ou ativos circulantes. Com uma depuração sistêmica de cerca de 10 L/h, a rivaroxabana pode ser classificada como um fármaco de baixa depuração. A eliminação da rivaroxabana do plasma ocorreu com meias-vidas terminais de 5 a 9 horas em indivíduos jovens e com meias-vidas terminais de 11 a 13 horas em idosos.
- Pacientes geriátricos
Pacientes idosos apresentaram concentrações plasmáticas mais altas que pacientes mais jovens, com valores médios de AUC aproximadamente 1,5 vezes maiores, devido principalmente à redução (aparente) da depuração total e renal (ver "Posologia e Modo de Usar").
- Gênero
Não há diferenças clinicamente relevantes da farmacocinética entre pacientes homens e mulheres (ver "Posologia e Modo de Usar").
- Peso Corporal
Pesos corpóreos extremos ( < 50 kg vs > 120 kg) tiveram apenas pequena influência nas concentrações plasmáticas de rivaroxabana (menos de 25%) (ver "Posologia e Modo de Usar").
- Crianças e adolescentes
A segurança e a eficácia não foram estabelecidas para crianças e adolescentes com idade inferior a 18 anos (ver "Posologia e Modo de Usar").
- Diferenças étnicas
Não foram observadas diferenças clinicamente relevantes entre pacientes caucasianos, afro-americanos, hispânicos, japoneses ou chineses em relação à farmacocinética e farmacodinâmica (ver "Posologia e Modo de Usar").
- Insuficiência hepática
O efeito de insuficiências hepáticas na farmacocinética da rivaroxabana foi estudado em indivíduos categorizados de acordo com a classificação Child Pugh, um procedimento padrão no desenvolvimento clínico. O propósito original da classificação Child Pugh é avaliar o prognóstico da doença hepática crônica, principalmente cirrose. Em pacientes nos quais o uso de anticoagulantes é pretendido, o aspecto crítico da insuficiência hepática é a redução da síntese de fatores de coagulação normais no fígado. Devido ao fato de que este aspecto é considerado em apenas um dos cinco medidores clínicos/bioquímicos que compõem o sistema de classificação Child Pugh, o risco de sangramentos em pacientes pode não ser claramente correlacionado com esta classificação. A decisão de tratar os pacientes com anticoagulantes deve ser, portanto, tomada independentemente da classificação Child Pugh.
Xarelto® (rivaroxabana) é contraindicado em pacientes com doença hepática associada à coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C.
Pacientes cirróticos com insuficiência hepática leve (classificados como Child Pugh A) apresentaram apenas pequenas alterações na farmacocinética da rivaroxabana (aumento de 1,2 vezes da AUC, em média), próximas das de seu respectivo grupo controle sadio. Nenhuma diferença relevante nas propriedades farmacodinâmicas foi observada entre estes grupos.
Em pacientes cirróticos com insuficiência hepática moderada (classificados como Child Pugh B), a média da AUC da rivaroxabana foi significativamente aumentada em 2,3 vezes comparada com voluntários sadios, devido à importante insuficiência na depuração do fármaco, o que indica uma significante doença hepática. A AUC da fração não-ligada foi aumentada em 2,6 vezes. Não há dados em pacientes com insuficiência hepática grave.
A inibição da atividade do fator Xa foi aumentada por um fator de 2,6 quando comparada a voluntários sadios; o prolongamento do TP foi similarmente aumentado por um fator de 2,1. O teste global de coagulação TP avalia a via extrínseca que compreende os fatores de coagulação VII, X, V, II e I que são sintetizados no fígado. Pacientes com insuficiência hepática moderada foram mais sensíveis à rivaroxabana, resultando em uma relação Farmacocinética/Farmacodinâmica mais acentuada entre concentração e TP.
Não há dados disponíveis para pacientes Child Pugh C (ver "Posologia e Modo de Usar" e "Contraindicações").
- Insuficiência renal
Houve um aumento na exposição à rivaroxabana inversamente correlacionada com a diminuição da função renal, como avaliado pela medida da depuração de creatinina.
Em indivíduos com insuficiência renal leve (ClCr ≤ 80-50 mL/min), moderada (ClCr < 50-30 mL/min) ou grave (ClCr < 30-15 mL/min), as concentrações plasmáticas de rivaroxabana (AUC) foram 1,4; 1,5 e 1,6 vezes maiores, respectivamente, comparadas com voluntários sadios (ver "Posologia e Modo de Usar" e "Advertências e Precauções").
Aumentos correspondentes nos efeitos farmacodinâmicos foram mais pronunciados (ver "Posologia e Modo de Usar" e "Advertências e Precauções").
Em indivíduos com insuficiência renal leve, moderada ou grave, a inibição total da atividade do fator Xa foi aumentada por um fator 1,5; 1,9 e 2,0, respectivamente quando comparada com voluntários sadios; prolongamento do TP foi similarmente aumentado por um fator de 1,3; 2,2 e 2,4, respectivamente. Não há dados em pacientes com ClCr < 15 mL/min.
O uso não é recomendado em pacientes com depuração de creatinina < 15 mL/min. Xarelto® (rivaroxabana) deve ser utilizado com cautela em pacientes com insuficiência renal grave (depuração de creatinina < 30-15 mL/min) (ver "Posologia e Modo de Usar" e "Advertências e Precauções").
Devido à doença de base, pacientes com insuficiência renal grave apresentam risco aumentado de sangramento e trombose.
- Administração Concomitante de Potentes Indutores da CYP3A4
Em um estudo de fase I, a coadministração de Xarelto® (rivaroxabana) com a rifampicina, um potente indutor da isoenzima CYP3A4 e gp-P (glicoproteína-P), levou a uma redução de aproximadamente 50% na AUC média da rivaroxabana, com reduções paralelas em seus efeitos farmacodinâmicos (ver "Interações Medicamentosas").
Em um estudo fase IIa, a relação PK/PD de um regime de dose de rivaroxabana adaptada (30 mg duas vezes ao dia nas primeiras três semanas de tratamento, seguidos por 20 mg duas vezes ao dia) foi estudada em 19 pacientes tratados para TVP ou EP e que, concomitantemente foram medicados com um potente indutor da isoenzima CYP 3A4 e gp-P (rifampicina ou fenitoína). O regime de dose adaptado nesses pacientes levou a uma exposição e farmacodinâmica similares, quando comparado a pacientes tratados para TVP (15 mg duas vezes ao dia nas primeiras três semanas de tratamento, seguido por 20 mg uma vez ao dia) sem a administração concomitante de um potente indutor da isoenzima CYP 3A4.
• Dados de segurança pré-clínicos
A avaliação de segurança não-clínica em dados de estudos convencionais e apropriados de segurança farmacológica, toxicidade de dose única e de doses repetidas, genotoxicidade, fototoxicidade e carcinogenicidade e toxicidade para a reprodução não revelou nenhum perigo para humanos.
Não foi observada toxicidade órgão-específica de rivaroxabana até a mais alta dose testada.
- Segurança farmacológica
As funções cardiovascular, respiratória e do SNC não foram afetadas. Não se observou potencial pró-arritmogênico.
Não foram observados efeitos clinicamente relevantes na motilidade gastrintestinal, função hepática, função renal e níveis de glicose sanguínea.
- Toxicidade aguda e de doses repetidas
A rivaroxabana mostrou baixa toxicidade aguda em ratos e camundongos.
A rivaroxabana foi testada em estudos de doses repetidas por até 6 meses em ratos e por até 12 meses em cães. Com base no modo de ação farmacológico, não se pôde estabelecer NOEL (Nível de efeito não observado) em razão dos efeitos sobre o tempo de coagulação. Todos os achados adversos, exceto uma discreta redução do ganho de peso corporal em ratos e cães, puderam ser relacionados a um modo de ação farmacológico exagerado do composto. Em cães com exposições muito altas, foram observados sangramentos importantes espontâneos. Os NOAELs (Níveis de efeitos adversos não observados) depois de exposição crônica são 12,5 mg/kg em ratos e 5 mg/kg em cães.
- Carcinogenicidade
A rivaroxabana foi testada com doses de até 60 mg/kg/dia, atingindo níveis de exposição similares aos seres humanos (camundongo) ou até 3,6 vezes maiores (ratos) do que nos seres humanos.
A rivaroxabana não apresentou potencial carcinogênico em ratos e camundongos.
- Toxicologia para a reprodução
A rivaroxabana foi testada em estudos de toxicidade para o desenvolvimento em níveis de exposição de até 14 vezes (rato) e de até 33 vezes (coelho) acima da exposição terapêutica em humanos. O perfil toxicológico se caracteriza principalmente por toxicidade materna causada por efeitos farmacodinâmicos exagerados. Até a dose mais alta testada, não se identificou potencial teratogênico primário (ver "Gravidez e lactação").
A radioatividade relacionada à [C14] rivaroxabana penetrou na barreira placentária em ratos. Em nenhum dos órgãos e tecidos fetais, a exposição, em termos de concentrações máximas ou AUC, excedeu a exposição sanguínea materna. A exposição média nos fetos, baseada na AUC (0 - 24), chegou a cerca de 20% da exposição no sangue materno. As glândulas mamárias tinham uma AUC aproximadamente equivalente à do sangue, o que indica secreção de radioatividade no leite (ver "Gravidez e lactação").
A rivaroxabana não mostrou efeito sobre a fertilidade masculina ou feminina até 200 mg/kg (ver "Gravidez e lactação").
- Lactação
Administrou-se [C14] rivaroxabana por via oral a ratas lactantes Wistar (dia 8 a 10 do pós-parto) em dose oral única de 3 mg/kg de peso corporal.
A radioatividade relacionada à [C14] rivaroxabana foi secretada no leite das ratas lactantes somente num grau baixo em relação à dose administrada: A quantidade estimada de radioatividade excretada com o leite foi de 2,12% da dose materna no prazo de 32 horas depois da administração (ver "Gravidez e lactação").
- Genotoxicidade
Não se observou genotoxicidade num teste para mutação genética em bactérias (Teste de Ames), num teste in vitro para aberrações cromossômicas ou no teste in vivo do micronúcleo.
Contraindicações.
Xarelto® (rivaroxabana) é contraindicado em pacientes com hipersensibilidade à rivaroxabana ou a qualquer outro componente do produto (ver "Composição"); em pacientes com sangramento ativo clinicamente significativo (por exemplo, sangramento intracraniano, sangramento gastrintestinal); e ainda em pacientes com doença hepática associada a coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C (ver "Propriedades Farmacocinéticas").
A segurança e a eficácia de Xarelto® (rivaroxabana) não foram estabelecidas em mulheres grávidas. Dados em animais mostram que a rivaroxabana atravessa a barreira placentária. Portanto, o uso de Xarelto® (rivaroxabana) é contraindicado durante toda a gravidez (ver "Gravidez e lactação" e "Dados de segurança pré-clínicos").
A segurança e a eficácia de Xarelto® (rivaroxabana) não foram estabelecidas em mulheres lactantes. Dados em animais indicam que a rivaroxabana é secretada no leite materno. Portanto, Xarelto® (rivaroxabana) só pode ser administrado depois que for descontinuada a amamentação (ver "Gravidez e lactação" e "Dados de segurança pré-clínicos").
Advertências e precauções.
• Pacientes com próteses valvulares
A segurança e eficácia de Xarelto® (rivaroxabana) não foram estudadas em pacientes com próteses de válvulas cardíacas; portanto, não há dados para suportar que Xarelto® (rivaroxabana) 20 mg (15 mg em pacientes com insuficiência renal moderada ou grave) forneça anticoagulação adequada nesta população de pacientes.
• Medicação concomitante
Xarelto® (rivaroxabana) não é recomendado em pacientes recebendo tratamento sistêmico concomitante com antimicóticos azólicos (por exemplo, cetoconazol) ou inibidores das proteases do HIV (por exemplo, ritonavir). Estes fármacos são potentes inibidores de CYP 3A4 e de gp-P. Portanto, estes fármacos podem aumentar as concentrações plasmáticas da rivaroxabana até um grau clinicamente relevante (2,6 vezes em média), o que pode levar ao aumento do risco de sangramentos (ver "Interações Medicamentosas").
Entretanto, o antimicótico azólico fluconazol, um inibidor moderado do CYP3A4, tem menor efeito na exposição à rivaroxabana e pode ser co-administrado (ver "Interações Medicamentosas").
• Tratamento de TVP e EP: Insuficiência renal
Xarelto® (rivaroxabana) deve ser utilizado com cautela em pacientes com insuficiência renal que estejam recebendo co-medicações que levem ao aumento da concentração de rivaroxabana no plasma (ver "Interações Medicamentosas").
• Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular, TVP e EP: Insuficiência renal
Em pacientes com insuficiência renal grave (ClCr < 30 mL/min), os níveis plasmáticos de rivaroxabana podem elevar-se significativamente (1,6 vezes na média), o que pode levar a um aumento do risco de sangramento. Em razão da doença de base, estes pacientes têm um aumento do risco de sangramento e de trombose.
Em virtude dos dados clínicos limitados, Xarelto® (rivaroxabana) deve ser utilizado com cautela nos pacientes com ClCr < 30 - 15 mL/min (ver "Propriedades Farmacocinéticas").
Não há dados clínicos disponíveis para pacientes com insuficiência renal grave (ClCr < 15 mL/min). Portanto o uso de Xarelto® (rivaroxabana) não é recomendado nestes pacientes (ver "Posologia e Modo de Usar" e "Propriedades Farmacocinéticas").
Após o início do tratamento, os pacientes com insuficiência renal grave ou risco aumentado de sangramentos e aqueles que recebem tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores das proteases do HIV devem ser cuidadosamente monitorados quanto a sinais de complicações hemorrágicas (ver "Interações Medicamentosas").
• Risco de sangramento
Xarelto® (rivaroxabana), como outros antitrombóticos, deve ser utilizado com cautela em pacientes com risco aumentado de sangramento, tais como:
- distúrbios hemorrágicos adquiridos ou congênitos;
- hipertensão arterial grave não controlada;
- doença gastrintestinal ulcerativa ativa;
- ulcerações gastrintestinais recentes;
- retinopatia vascular;
- hemorragia intracraniana ou intracerebral recente;
- anormalidades vasculares intraespinais ou intracerebrais;
- cirurgia cerebral, espinal ou oftalmológica recente;
- bronquiectasia ou história de sangramento pulmonar.
Deve-se ter cuidado se os pacientes forem tratados concomitantemente com fármacos que interferem na hemostasia, como os anti-inflamatórios não-esteroidais (AINEs), ácido acetilsalicílico, os inibidores da agregação plaquetária ou outros antitrombóticos.
Pode-se considerar tratamento profilático apropriado para pacientes com risco de doença ulcerativa gastrintestinal (ver "Interações Medicamentosas").
Qualquer queda de hemoglobina ou da pressão arterial sem explicação deve levar à investigação de um local com sangramento.
• Cirurgia e intervenções
Se um procedimento invasivo ou uma intervenção cirúrgica forem necessários, Xarelto® (rivaroxabana) deve ser interrompido pelo menos 24 horas antes da intervenção, se possível, e com base no julgamento clínico do médico.
Se o procedimento não puder ser adiado, o aumento do risco de sangramento deve ser avaliado em relação à urgência de tal intervenção.
A administração de Xarelto® (rivaroxabana) deve ser reiniciada após o procedimento invasivo ou a intervenção cirúrgica, o mais rapidamente possível, desde que a situação clínica do paciente permita e a sua hemostasia adequada tenha sido estabelecida (ver "Propriedades Farmacocinéticas ").
• Prolongamento do QTc
Não foi observado efeito de prolongamento do QTc com o uso de Xarelto® (rivaroxabana) (ver "Propriedades Farmacocinéticas").
• Informação sobre os excipientes
Como este medicamento contém lactose, os pacientes com problemas hereditários raros de intolerância à lactose ou à galactose (por exemplo, deficiência de lactase de Lapp ou má absorção de glicose-galactose) não devem tomar Xarelto® (rivaroxabana) (ver "Composição").
• Tratamento de TVP e EP: pacientes com embolia pulmonar hemodinamicamente instáveis ou pacientes que necessitam de trombólise ou embolectomia pulmonar
Xarelto® (rivaroxabana) não é recomendado como uma alternativa à heparina não fracionada em pacientes com embolia pulmonar que estão hemodinamicamente instáveis ou que podem receber trombólise ou embolectomia pulmonar, uma vez que a segurança e eficácia de Xarelto® (rivaroxabana) não foram estabelecidas nestas situações clínicas.
• Gravidez e lactação
- Gravidez
A segurança e a eficácia de Xarelto® (rivaroxabana) não foram estabelecidas em mulheres grávidas.
Em ratas e coelhas, a rivaroxabana mostrou pronunciada toxicidade materna, com alterações placentárias relacionadas ao seu modo de ação farmacológico (por exemplo, complicações hemorrágicas) levando à toxicidade reprodutiva (ver "Dados de segurança pré-clínicos"). Não se identificou potencial teratogênico primário. Devido ao risco intrínseco de sangramentos e a evidência de que a rivaroxabana atravessa a placenta, Xarelto® (rivaroxabana) é contraindicado na gravidez (ver "Contraindicações" e "Dados de segurança pré-clínicos").
- Lactação
A segurança e a eficácia de Xarelto® (rivaroxabana) não foram estabelecidas em lactantes. Em ratas, a rivaroxabana é secretada no leite materno. Portanto, Xarelto® (rivaroxabana) só pode ser administrado depois de descontinuada a amamentação (ver "Contraindicações" e "Dados de segurança pré-clínicos").
• Mulheres em idade fértil
Xarelto® (rivaroxabana) deve ser utilizado em mulheres em idade fértil somente com um método contraceptivo eficaz.
• Efeito sobre a capacidade de dirigir veículos ou operar máquinas
Foram reportadas síncopes e tonturas, o que pode afetar a habilidade de dirigir veículos e operar máquinas (ver "Reações adversas"). Pacientes que experimentarem estas reações não devem dirigir ou operar máquinas.
Interações medicamentosas.
• Interações farmacocinéticas
A rivaroxabana é eliminada principalmente pelo metabolismo hepático mediado pelo citocromo P450 (CYP 3A4, CYP 2J2) e por excreção renal do fármaco inalterado, envolvendo sistemas de transportadores glicoproteína-P (gp-P) / proteína de resistência ao câncer de mama (Bcrp).
• Inibição do CYP
A rivaroxabana não inibe o CYP 3A4 nem qualquer outra isoforma principal de CYP.
• Indução do CYP
A rivaroxabana não induz o CYP 3A4 nem qualquer outra isoforma principal de CYP.
• Efeitos na rivaroxabana
O uso concomitante de Xarelto® (rivaroxabana) com inibidores potentes do CYP 3A4 e de gp-P pode levar à redução da depuração hepática e renal e, deste modo, ao aumento significativo da exposição sistêmica.
A coadministração de Xarelto® (rivaroxabana) com o antimicótico azólico cetoconazol (400 mg uma vez ao dia), um potente inibidor do CYP 3A4 e de gp-P, levou a um aumento de 2,6 vezes da AUC média da rivaroxabana no estado de equilíbrio e um aumento de 1,7 vezes da Cmáx média da rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos.
A coadministração de Xarelto® (rivaroxabana) com o inibidor de protease do HIV ritonavir (600 mg duas vezes ao dia), um potente inibidor de CYP 3A4 e de gp-P, levou a um aumento de 2,5 vezes da AUC média da rivaroxabana e a um aumento de 1,6 vezes da Cmáx média de rivaroxabana, com elevações significativas de seus efeitos farmacodinâmicos.
Portanto, Xarelto® (rivaroxabana) não é recomendado em pacientes que estejam recebendo tratamento sistêmico concomitante com antimicóticos azólicos ou inibidores de proteases do HIV (ver "Advertências e Precauções").
Para outros fármacos que inibam potentemente apenas uma das vias de eliminação da rivaroxabana, seja CYP 3A4 ou gp-P, é esperado que o aumento das concentrações plasmáticas de rivaroxabana seja de menor extensão.
A claritromicina (500 mg duas vezes ao dia), considerada um potente inibidor do CYP 3A4 e inibidor moderado da gp-P, levou ao aumento de 1,5 vezes da AUC média da rivaroxabana e de 1,4 vezes da Cmáx. Este aumento, que está próximo à magnitude da variabilidade normal da AUC e Cmáx, é considerado clinicamente irrelevante.
A eritromicina (500 mg três vezes ao dia), que inibe moderadamente CYP 3A4 e gp-P, levou a um aumento de 1,3 vezes da AUC e da Cmáx média da rivaroxabana. Este aumento está dentro da magnitude de variabilidade normal de AUC e Cmáx e é considerado clinicamente irrelevante.
O fluconazol (400 mg uma vez ao dia), considerado um inibidor moderado do CYP 3A4, levou a um aumento de 1,4 vezes da AUC média da rivaroxabana e 1,3 vezes da Cmáx. Este aumento está dentro da magnitude de variabilidade normal da AUC e Cmáx e é considerado como clinicamente irrelevante (ver "Advertências e Precauções").
Em função de dados clínicos limitados disponíveis com dronedarona, a coadministração deve ser evitada.
A coadministração de Xarelto® (rivaroxabana) com o potente indutor de CYP 3A4 e de gp-P rifampicina, levou a uma diminuição aproximada de 50% da AUC média da rivaroxabana, havendo diminuições paralelas em seus efeitos farmacodinâmicos (ver "Propriedades Farmacocinéticas").
O uso concomitante de Xarelto® (rivaroxabana) com outros indutores potentes do CYP 3A4 (por exemplo, fenitoína, carbamazepina, fenobarbital ou Erva d
e São João) também pode levar a uma diminuição da concentração plasmática de rivaroxabana. Indutores potentes do CYP 3A4 devem ser coadministrados com cautela (ver "Propriedades Farmacocinéticas").
• Interações farmacodinâmicas
Após administração combinada de enoxaparina (40 mg em dose única) com Xarelto® (rivaroxabana) (10 mg em dose única), foi observado um efeito aditivo sobre a atividade anti fator Xa sem qualquer efeito adicional sobre os testes de coagulação (TP, TTPa). A enoxaparina não afetou a farmacocinética da rivaroxabana (ver "Advertências e Precauções").
O clopidogrel (300 mg em dose de ataque, seguida por 75 mg de dose de manutenção) não mostrou interação farmacocinética (com Xarelto® (rivaroxabana) 15 mg), mas foi observado um aumento relevante dos tempos de sangramento num subgrupo de pacientes, e esse efeito não foi correlacionado à agregação plaquetária, à P-selectina ou aos níveis de receptores de GPIIb/IIIa (ver "Advertências e Precauções").
Não foi observado prolongamento clinicamente relevante do tempo de sangramento após administração concomitante de Xarelto® (rivaroxabana) (15 mg) e 500 mg de naproxeno. Todavia, pode haver indivíduos com resposta farmacodinâmica mais pronunciada (ver "Advertências e Precauções").
Ao converter pacientes de varfarina (RNI 2,0 - 3,0) para Xarelto® (rivaroxabana) (20 mg) ou de Xarelto® (rivaroxabana) (20 mg) para varfarina (RNI 2,0 - 3,0) aumentou o tempo de protrombina (TP)/RNI (Neoplastin®) mais que aditivamente (valores individuais de RNI de até 12 podem ser observados), enquanto os efeitos sobre o TTPa, a inibição da atividade do fator Xa e o potencial de trombina endógena foram aditivos.
Se for desejado testar os efeitos farmacodinâmicos de Xarelto® (rivaroxabana) durante o período de conversão, a atividade anti-fator Xa, PiCT e HepTest® podem ser usados como testes, os quais não são afetados pela varfarina.
A partir de quatro dias da interrupção da varfarina, todos os testes (incluindo o TP, TTPa, a inibição da atividade do fator Xa e ETP) refletiram apenas o efeito do Xarelto® (rivaroxabana) (ver "Posologia e Modo de Usar").
Se for desejado testar os efeitos farmacodinâmicos da varfarina durante o período de conversão, a avaliação da RNI pode ser utilizada na concentração mínima da rivaroxabana (24 horas após a ingestão anterior da rivaroxabana) uma vez que este teste é minimamente afetado pela rivaroxabana neste ponto de tempo.
Nenhuma interação farmacocinética foi observada entre varfarina e Xarelto® (rivaroxabana).
• Alimentos e laticínios
Xarelto® (rivaroxabana) 15 mg e Xarelto® (rivaroxabana) 20 mg devem ser tomados com alimentos (ver "Propriedades Farmacocinéticas").
• Interações que demonstraram não existir
Não houve interações farmacocinéticas mútuas entre rivaroxabana e midazolam (substrato de CYP 3A4), digoxina (substrato de glicoproteína-P) ou atorvastatina (substrato de CYP 3A4 e gp-P).
A coadministração do inibidor da bomba de prótons omeprazol, do antagonista do receptor H2 ranitidina, do antiácido hidróxido de alumínio / hidróxido de magnésio, naproxeno, clopidogrel ou enoxaparina não afetou a biodisponibilidade e a farmacocinética da rivaroxabana.
Não foram observadas interações farmacocinéticas ou farmacodinâmicas clinicamente significativas quando Xarelto® (rivaroxabana) foi coadministrado com 500 mg de ácido acetilsalicílico.
• Interações com parâmetros laboratoriais
Os testes de parâmetros da coagulação (TP, TTPa, HepTest®) são afetados como esperado pelo modo de ação de Xarelto® (rivaroxabana) (ver "Propriedades Farmacodinâmicas").
Cuidados de armazenamento.
Xarelto® (rivaroxabana) deve ser conservado em temperatura ambiente (entre 15°C e 30°C).
O prazo de validade de Xarelto® (rivaroxabana) 15 mg e 20 mg é de 36 meses a partir da data de fabricação.
"Número de lote e datas de fabricação e validade: vide embalagem."
"Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original."
Xarelto® (rivaroxabana) 15 mg é um comprimido revestido redondo vermelho.
Xarelto® (rivaroxabana) 20 mg é um comprimido revestido redondo vermelho amarronzado.
"Antes de usar, observe o aspecto do medicamento."
"Todo medicamento deve ser mantido fora do alcance das crianças."
Posologia e modo de usar.
• Dosagem e método de administração: Prevenção de acidente vascular cerebral e embolia sistêmica em pacientes com fibrilação atrial não-valvular
- Método de administração:
Uso oral
- Dose usual recomendada:
A dose recomendada é de 20 mg uma vez ao dia.
- Duração do tratamento:
A terapia deve ser continuada enquanto os fatores de risco para AVC e embolia sistêmica persistirem.
- Método e frequência da administração:
Deve ser ingerido um comprimido de 20 mg de Xarelto® (rivaroxabana) por dia.
Xarelto® (rivaroxabana) 20 mg e Xarelto® (rivaroxabana) 15 mg devem ser ingeridos com alimentos (ver "Propriedades Farmacocinéticas").
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Xarelto® (rivaroxabana) pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral. Após a administração do comprimido triturado de Xarelto® (rivaroxabana) 15 mg ou de Xarelto® (rivaroxabana) 20 mg, a dose deve ser imediatamente seguida por alimento.
O comprimido de Xarelto® (rivaroxabana) triturado pode ser administrado por sonda gástrica. Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Xarelto® (rivaroxabana). O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração. Após a administração do comprimido triturado de Xarelto® (rivaroxabana) 15 mg ou de Xarelto® (rivaroxabana) 20 mg, a dose deve ser imediatamente seguida por nutrição enteral (ver "Propriedades farmacocinéticas").
- Doses esquecidas:
Em caso de esquecimento de uma dose, o paciente deve tomar Xarelto® (rivaroxabana) imediatamente e continuar com a tomada uma vez ao dia, conforme recomendado, no dia seguinte.
Não deve ser tomada dose em dobro para compensar uma dose esquecida dentro do mesmo dia.
- Dose diária máxima:
A dose máxima recomendada diariamente é 20 mg.
- Informações adicionais para populações especiais:
Pacientes com insuficiência hepática
Xarelto® (rivaroxabana) é contraindicado em pacientes com doença hepática associada a coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C (ver "Contraindicações" e "Propriedades Farmacocinéticas").
Pacientes com insuficiência renal
Não é requerido ajuste de dose em pacientes com insuficiência renal leve (depuração de creatinina (ClCr): ≤ 80 - 50 mL/min) (ver "Propriedades Farmacocinéticas"). Para pacientes com insuficiência renal moderada (depuração de creatinina (ClCr): < 50 - 30 mL/min) ou grave (depuração de creatinina (ClCr): < 30 - 15 mL/min) a dose recomendada é de 15 mg uma vez ao dia (ver "Propriedades Farmacocinéticas").
Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr: < 30 - 15 mL/min) indicam que as concentrações plasmáticas da rivaroxabana são significativamente aumentadas, portanto, Xarelto® (rivaroxabana) deve ser utilizado com precaução nestes pacientes (ver "Advertências e Precauções" e "Propriedades Farmacocinéticas").
O uso de Xarelto® (rivaroxabana) não é recomendado em pacientes com ClCr < 15 mL/min (ver "Advertências e Precauções" e "Propriedades Farmacocinéticas").
Convertendo de antagonistas de vitamina K (AVK) para Xarelto® (rivaroxabana)
O tratamento com AVK deve ser interrompido e iniciada a terapia com Xarelto® (rivaroxabana) assim que o valor de RNI for ≤ 3,0.
Em pacientes convertidos de AVKs para Xarelto® (rivaroxabana), os valores de RNI serão falsamente elevados após a ingestão de Xarelto® (rivaroxabana). O RNI não é válido para medir a atividade anticoagulante de Xarelto® (rivaroxabana), e desta forma não deve ser usado para este fim (ver "Interações Medicamentosas").
Convertendo de Xarelto® (rivaroxabana) para antagonistas de vitamina K (AVK)
Existe um potencial para anticoagulação inadequada durante a transição de Xarelto® (rivaroxabana) para AVK. A anticoagulação adequada contínua deve ser assegurada durante qualquer transição para um anticoagulante alternativo. Deve ser observado que Xarelto® (rivaroxabana) pode contribuir para um valor elevado de RNI.
Em pacientes convertidos de Xarelto® (rivaroxabana) para AVK, o AVK deve ser administrado concomitantemente até que os valores de RNI sejam ≥ 2,0. Para os dois primeiros dias do período de conversão, a dose padrão de AVK deve ser utilizada seguida pela dose de AVK ajustada de acordo com os testes de RNI. Enquanto os pacientes receberem ambos, Xarelto® (rivaroxabana) e AVK, a medida de RNI não deve ser realizada antes de 24 horas (após a dose anterior, mas antes da próxima dose de Xarelto® (rivaroxabana)). Com a descontinuação de Xarelto® (rivaroxabana), o teste de RNI pode ser feito de forma confiável 24 horas após a última dose (ver "Interações Medicamentosas).
Convertendo de anticoagulantes parenterais para Xarelto® (rivaroxabana)
Para pacientes que estejam atualmente recebendo um anticoagulante parenteral, Xarelto® (rivaroxabana) deve ser iniciado 0 a 2 horas antes do horário previsto para próxima administração do medicamento parenteral (por exemplo, heparina de baixo peso molecular) ou no momento da descontinuação da administração parenteral contínua do medicamento (por exemplo, heparina não fracionada intravenosa).
Convertendo de Xarelto® (rivaroxabana) para anticoagulantes parenterais
Descontinue o uso de Xarelto® (rivaroxabana) e administre a primeira dose do anticoagulante parenteral no momento em que a próxima dose de Xarelto® (rivaroxabana) seria administrada.
Crianças e adolescentes (do nascimento aos 18 anos)
A segurança e a eficácia não foram estabelecidas em crianças e adolescentes abaixo de 18 anos.
Pacientes idosos
Não é requerido ajuste de dose com base na idade do paciente (ver "Propriedades Farmacocinéticas").
Gênero
Não é requerido ajuste de dose com base no sexo do paciente (ver "Propriedades Farmacocinéticas").
Peso corporal
Não é requerido ajuste de dose com base no peso corporal do paciente (ver "Propriedades Farmacocinéticas").
Diferenças étnicas
Não é requerido ajuste de dose com base em diferenças étnicas (ver "Propriedades Farmacocinéticas").
• Dosagem e método de administração no tratamento de TVP e EP
- Método de administração:
Uso oral
- Dose usual recomendada:
A dose recomendada para o tratamento inicial de TVP e EP agudos é de 15 mg de Xarelto® (rivaroxabana) duas vezes ao dia para as três primeiras semanas, seguido por 20 mg uma vez ao dia para a continuação do tratamento e para a prevenção da TVP e de EP recorrentes.
- Duração do tratamento:
Para TVP, a duração do tratamento deve ser individualizada após cuidadosa avaliação do benefício do tratamento contra o risco de sangramento (ver "Advertências e Precauções"). A terapia de curta duração (3 meses) deve ser baseada em fatores de risco transitórios (por exemplo, cirurgia recente, trauma, imobilização) e durações mais longas devem ser baseadas em fatores de risco permanentes ou TVP idiopática. A experiência com Xarelto® (rivaroxabana) nesta indicação por mais de 12 meses é limitada.
Para EP, a duração do tratamento deve ser individualizada após cuidadosa avaliação do benefício do tratamento contra o risco de sangramento (ver "Advertências e Precauções"). A terapia de curta duração (pelo menos 3 meses) deve ser baseada em fatores de risco transitórios (por exemplo, cirurgia recente, trauma, imobilização) e durações mais longas devem ser baseadas em fatores de risco permanentes ou EP idiopática.
- Método e frequência da administração:
Durante as primeiras 3 semanas de tratamento agudo, Xarelto® (rivaroxabana) 15 mg deve ser tomado 2 vezes ao dia.
Após as primeiras 3 semanas o tratamento com Xarelto® (rivaroxabana) deve ser continuado com 20 mg uma vez ao dia.
Xarelto® (rivaroxabana) 15 mg e Xarelto® (rivaroxabana) 20 mg devem ser tomados junto com alimentos (ver "Propriedades Farmacocinéticas").
Para pacientes que não conseguem engolir comprimidos inteiros, o comprimido de Xarelto® (rivaroxabana) pode ser triturado e misturado com água ou alimentos pastosos, como purê de maçã, imediatamente antes da utilização, e administrado por via oral. Após a administração do comprimido triturado de Xarelto® (rivaroxabana) 15 mg ou de Xarelto® (rivaroxabana) 20 mg, a dose deve ser imediatamente seguida por alimento.
O comprimido de Xarelto® (rivaroxabana) triturado pode ser administrado por sonda gástrica. Deve-se confirmar o posicionamento da sonda gástrica antes de administrar Xarelto® (rivaroxabana). O comprimido triturado deve ser administrado em uma pequena quantidade de água através de uma sonda gástrica, que deve ser lavada com água após a administração. Após a administração do comprimido triturado de Xarelto® (rivaroxabana) 15 mg ou de Xarelto® (rivaroxabana) 20 mg, a dose deve ser imediatamente seguida por nutrição enteral (ver "Propriedades farmacocinéticas").
- Doses esquecidas:
É essencial aderir ao esquema de dose recomendado.
Se for esquecida uma dose durante a fase de tratamento com 15 mg duas vezes ao dia (dia 1 - 21), o paciente deve tomar Xarelto® (rivaroxabana) imediatamente para garantir a ingestão de 30 mg por dia do medicamento. Nesse caso, dois comprimidos de 15 mg podem ser tomados de uma só vez. O paciente deve continuar tomando a dose regular de 15 mg duas vezes ao dia no dia seguinte, conforme recomendado.
Se for esquecida uma dose durante a fase de tratamento com uma ingestão ao dia (dia 22 em diante), o paciente deve tomar Xarelto® (rivaroxabana) imediatamente e continuar no dia seguinte com uma ingestão ao dia, conforme recomendado. A dose não deve ser dobrada no mesmo dia para compensar uma dose perdida.
- Dose diária máxima:
A dose diária máxima recomendada é de 30 mg durante as três semanas iniciais do tratamento. Na fase de continuação do tratamento a dose diária máxima recomendada é de 20 mg.

- Informações adicionais sobre populações especiais:
Pacientes com insuficiência hepática
Xarelto® (rivaroxabana) é contraindicado em pacientes com doença hepática associada à coagulopatia e risco de sangramento clinicamente relevante, incluindo pacientes cirróticos com Child Pugh B e C (ver "Contraindicações" e "Propriedades Farmacocinéticas").
Pacientes com insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal leve (depuração de creatinina (ClCr): ≤ 80 - 50 mL/min) (veja subitem "Propriedades Farmacocinéticas").
O tratamento para pacientes com insuficiência renal moderada (depuração de creatinina (ClCr): < 50 - 30 mL/min) ou grave (depuração de creatinina (ClCr): < 30 - 15 mL/min) deve ser 15 mg duas vezes ao dia durante as três primeiras semanas. Após esse período, é recomendada uma dose de 15 mg uma vez ao dia, baseado no modelo de Farmacocinética (ver "Advertências e Precauções" e "Propriedades Farmacocinéticas").
Dados clínicos limitados para pacientes com insuficiência renal grave (ClCr < 30 - 15 mL/min) indicam que as concentrações plasmáticas de rivaroxabana aumentam significativamente, portanto, Xarelto® (rivaroxabana) deve ser utilizado com cautela nestes pacientes.
O uso de Xarelto® (rivaroxabana) não é recomendado para pacientes com ClCr < 15 mL/min (ver "Advertências e Precauções" e "Propriedades Farmacocinéticas").
Convertendo de antagonistas de vitamina K (AVK) para Xarelto® (rivaroxabana)
O tratamento com AVK deve ser interrompido e iniciado com Xarelto® (rivaroxabana) assim que os valores de RNI forem ≤ 2,5.
Em pacientes convertidos de AVKs para Xarelto® (rivaroxabana), os valores de RNI serão falsamente elevados após a ingestão de Xarelto® (rivaroxabana). O RNI não é válido para medir a atividade anticoagulante de Xarelto® (rivaroxabana), e desta forma não deve ser usado para este fim (ver "Interações Medicamentosas").
Convertendo de Xarelto® (rivaroxabana) para antagonistas de vitamina K (AVK)
Existe um potencial para anticoagulação inadequada durante a transição de Xarelto® (rivaroxabana) para AVK. A anticoagulação adequada contínua deve ser assegurada durante qualquer transição para um anticoagulante alternativo. Deve ser observado que Xarelto® (rivaroxabana) pode contribuir para valores elevados de RNI.
Em pacientes convertidos de Xarelto® (rivaroxabana) para AVK, o AVK deve ser administrado concomitantemente até que os valores de RNI sejam ≥ 2,0. Para os dois primeiros dias do período de conversão, a dose padrão de AVK deve ser utilizada seguida pela dose de AVK ajustada de acordo com os testes de RNI. Enquanto os pacientes receberem ambos, Xarelto® (rivaroxabana) e AVK, a medida de RNI não deve ser realizada antes de 24 horas (após a dose anterior, mas antes da próxima dose de Xarelto® (rivaroxabana)). Com a descontinuação de Xarelto® (rivaroxabana), o teste de RNI pode ser feito de forma confiável 24 horas após a última dose (ver "Interações Medicamentosas").
Convertendo de anticoagulantes parenterais para Xarelto® (rivaroxabana)
Para pacientes recebendo atualmente um anticoagulante parenteral, Xarelto® (rivaroxabana) deve ser iniciado 0 a 2 horas antes do horário previsto para próxima administração do medicamento parenteral (por exemplo, heparina de baixo peso molecular) ou no momento da descontinuação da administração parenteral contínua do medicamento (por exemplo, heparina não fracionada intravenosa).
Convertendo de Xarelto® (rivaroxabana) para anticoagulantes parenterais
Descontinue o uso de Xarelto® (rivaroxabana) e administre a primeira dose do anticoagulante parenteral no momento em que a próxima dose de Xarelto® (rivaroxabana) seria administrada.
Crianças e adolescentes (do nascimento aos 18 anos)
A segurança e a eficácia não foram estabelecidas em crianças e adolescentes com idade inferior a 18 anos.
Pacientes idosos
Não é requerido ajuste de dose com base na idade do paciente (ver "Propriedades Farmacocinéticas").
Gênero
Não é requerido ajuste de dose com base no sexo do paciente (ver "Propriedades Farmacocinéticas").
Peso corporal
Não é requerido ajuste de dose com base no peso corporal do paciente (ver "Propriedades Farmacocinéticas").
Diferenças étnicas
Não é requerido ajuste de dose com base em diferenças étnicas (ver"Propriedades Farmacocinéticas").
Reações adversas.
• Resumo do perfil de segurança
A segurança de Xarelto® (rivaroxabana) foi avaliada em quatro estudos de fase III que incluíram 6.097 pacientes expostos a Xarelto® (rivaroxabana) 10 mg, submetidos a uma cirurgia ortopédica de grande porte nos membros inferiores (artroplastia total do quadril ou do joelho), em 3.997 pacientes enfermos hospitalizados tratados por até 39 dias e em três estudos de fase III para tratamento de TEV com 4.556 pacientes expostos a Xarelto® (rivaroxabana) 15 mg duas vezes ao dia por três semanas seguido de 20 mg uma vez ao dia, ou a 20 mg uma vez ao dia tratados por até 21 meses.
Além disso, a segurança de Xarelto® (rivaroxabana) foi também avaliada em 7.750 pacientes com fibrilação atrial não valvular de dois estudos clínicos de fase III com, pelo menos uma dose de Xarelto® (rivaroxabana) e em 10.225 pacientes com SCA com pelo menos uma dose de Xarelto® (rivaroxabana) 2,5 mg (duas vezes ao dia) ou 5 mg (duas vezes ao dia) junto com AAS ou AAS mais clopidogrel ou ticlopidina.
Em um total aproximado de 67% de pacientes expostos a pelo menos uma dose de rivaroxabana foram relatados eventos adversos emergentes ao tratamento. Cerca de 22% dos pacientes experimentaram reações adversas consideradas relacionadas ao tratamento conforme avaliado pelos investigadores. Em pacientes tratados com Xarelto® (rivaroxabana) 10 mg submetidos à artroplastia do quadril ou joelho e em pacientes enfermos hospitalizados, ocorreram sangramentos em aproximadamente 6,8% e 12,6% dos pacientes, respectivamente, e anemia ocorreu em aproximadamente 5,9% e 2,1% dos pacientes, respectivamente. Em pacientes tratados tanto com Xarelto® (rivaroxabana) 15 mg duas vezes ao dia seguido de 20 mg uma vez ao dia para o tratamento de TVP ou EP, quanto com Xarelto® (rivaroxabana) 20 mg uma vez ao dia para prevenção de TVP e de EP recorrentes, eventos de sangramento ocorreram em aproximadamente 27,8% dos pacientes e anemia ocorreu em aproximadamente 2,2% dos pacientes. Em pacientes tratados para prevenção de AVC e embolia sistêmica, sangramento de qualquer tipo ou gravidade foi reportado com uma taxa de eventos de 28 por 100 pacientes ao ano, e anemia com uma taxa de 2,5 por 100 pacientes ao ano. Em pacientes tratados para prevenção de morte cardiovascular e infarto do miocárdio após síndrome coronariana aguda (SCA), sangramento de qualquer tipo ou gravidade foi relatado com uma taxa de evento de 22 por 100 pacientes ao ano. Anemia foi relatada com uma taxa de 1,4 por 100 pacientes ao ano.
Em razão do modo de ação farmacológico, Xarelto® (rivaroxabana) pode ser associado a um risco aumentado de sangramento oculto ou manifesto em qualquer tecido ou órgão, o que pode resultar em anemia pós-hemorrágica. O risco de sangramento pode ser aumentado em certos grupos de pacientes, por exemplo, naqueles com hipertensão arterial grave não-controlada e/ou com medicação concomitante que afete a hemostasia (ver "Advertências e Precauções"). O sangramento menstrual pode ser intensificado e/ou prolongado.
Os sinais, sintomas e gravidade (incluindo desfecho fatal) irão variar de acordo com a localização e o grau ou extensão do sangramento e/ou anemia (ver "Superdose").
Complicações hemorrágicas podem se apresentar como fraqueza, palidez, tontura, cefaleia ou edema inexplicável, dispneia e choque inexplicável. Em alguns casos, como consequência da anemia, foram observados sintomas de isquemia cardíaca, tais como dor no peito ou angina pectoris.
Foram relatadas para Xarelto® (rivaroxabana) complicações conhecidas secundárias ao sangramento grave, como síndrome compartimental e falência renal devido à hipoperfusão. Portanto, deve-se considerar a possibilidade de uma hemorragia ao avaliar as condições de qualquer paciente anticoagulado.
• Lista tabulada de reações adversas
As frequências das reações adversas relatadas com Xarelto® (rivaroxabana) estão resumidas na tabela abaixo. As reações adversas estão apresentadas em ordem decrescente de gravidade dentro de cada grupo de frequência, que são definidas como muito frequente (≥ 1/10), frequente (≥ 1/100 a < 1/10), pouco frequente (≥ 1/1.000 a < 1/100) e rara (≥ 1/10.000 a < 1/1.000).
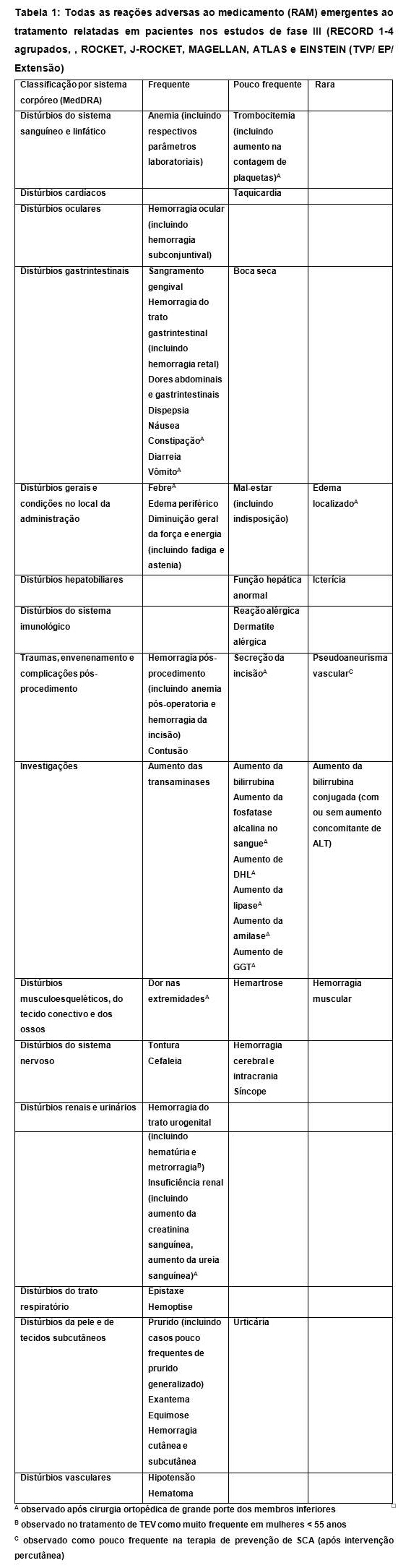
Observações pós-comercialização
Angioedema e edema alérgico foram relatados no período de pós-comercialização em associação temporal ao uso de Xarelto® (rivaroxabana). A frequência dessas reações adversas relatadas na experiência de pós-comercialização não pode ser estimada. Nos dados agrupados dos estudos Fase III, estes eventos foram pouco frequentes (≥ 1/1.000 a < 1/100).
"Atenção: este produto é um medicamento que possui nova concentração e nova indicação terapêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em www.anvisa.gov.br, ou para a Vigilância Sanitária Estadual ou Municipal."
Superdose.
Casos raros de superdosagem de até 600 mg foram reportados sem complicações hemorrágicas ou outras reações adversas. Devido a limitada absorção, um efeito teto com nenhum aumento adicional na exposição média ao plasma é esperado a uma dose supraterapêutica de 50 mg ou superior.
Não está disponível um antídoto específico para antagonizar os efeitos farmacodinâmicos da rivaroxabana.
Pode-se considerar o uso de carvão ativado para reduzir a absorção no caso de superdosagem de Xarelto® (rivaroxabana).
Devido à alta ligação da rivaroxabana às proteínas plasmáticas, não se espera que esta seja dialisável.
• Conduta na hemorragia
Caso ocorra uma complicação hemorrágica no paciente que estiver recebendo rivaroxabana, a próxima administração deve ser atrasada ou o tratamento deve ser descontinuado, conforme apropriado. A rivaroxabana tem meia-vida de aproximadamente 5 a 13 horas. A conduta deve ser individualizada de acordo com a gravidade e localização da hemorragia. Tratamento sintomático apropriado pode ser utilizado, se necessário, como compressão mecânica (por exemplo, na epistaxe grave), hemostase cirúrgica com procedimentos de controle de sangramento, reposição de líquidos e suporte hemodinâmico, transfusão de hemoderivados (células vermelhas embaladas ou plasma fresco congelado, dependendo da anemia ou coagulopatia associada) ou plaquetas.
Se o sangramento não puder ser controlado pelas medidas mencionadas acima, deve-se considerar a administração de um agente reverso procoagulante específico, como:
- concentrado de complexo protrombínico (CCP);
- concentrado de complexo protrombínicoativado (CCPa);
- fator VIIa recombinante (F VIIar).
No entanto, atualmente a experiência clínica com o uso destes produtos em pacientes recebendo Xarelto® (rivaroxabana) é muito limitada.
Não se espera que o sulfato de protamina e a vitamina K afetem a atividade anticoagulante da rivaroxabana.
Não há experiência com agentes antifibrinolíticos (ácido tranexâmico, ácido aminocaproico) em indivíduos que estejam recebendo Xarelto® (rivaroxabana). Também não há racional científico para o benefício, nem experiência com a desmopressão hemostática sistêmica e aprotinina em pacientes recebendo Xarelto® (rivaroxabana).
"Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações."
Dizeres legais.
MS - 1.7056.0048
Venda sob prescrição médica.
Laboratorio que comercializa Xarelto
BAYER →

