FIASP
NOVO NORDISK
insulina
Hipoglicemiante.
Apresentações.
Solução injetável de insulina asparte 100 U/mL, disponível em frasco-ampola com 10 mL. Cada embalagem contém 1 frasco-ampola.
VIA SUBCUTÂNEA E INTRAVENOSA
USO ADULTO E PEDIÁTRICO ACIMA DE 1 ANO
Composição.
O princípio ativo é a insulina asparte. 1 mL da solução contém 100 Unidades (U) (equivalente a 3,5 mg) de insulina asparte. Um frasco-ampola contém 1000 U de insulina asparte em 10 mL de solução injetável.
Excipientes: fenol, metacresol, glicerol, acetato de zinco, fosfato de sódio dibásico di-hidratado, cloridrato de arginina, nicotinamida, ácido clorídrico, hidróxido de sódio e água para injetáveis. A insulina asparte é produzida por tecnologia do DNA recombinante em Saccharomyces cerevisiae.
Informações técnicas.
1. INDICAÇÕES
Fiasp® é indicado para melhorar o controle glicêmico em adultos e crianças maiores de 1 ano de idade com diabetes mellitus.
2. RESULTADOS DE EFICÁCIA
• População adulta
Fiasp® foi avaliado em 2068 pacientes adultos randomizados com diabetes mellitus tipo 1 (1143 pacientes) e diabetes mellitus tipo 2 (925 pacientes) em 3 estudos de eficácia e segurança de longo prazo (18 -26 semanas de tratamento).
Pacientes com diabetes mellitus tipo 1:
Fiasp® foi efetivo na obtenção do controle glicêmico quando administrado pré-prandial ou pós-prandial. A redução na HbA1c foi estatística e significativamente maior com Fiasp® administrado na hora da refeição em comparação com NovoRapid® (Figura 1, Tabela 1).
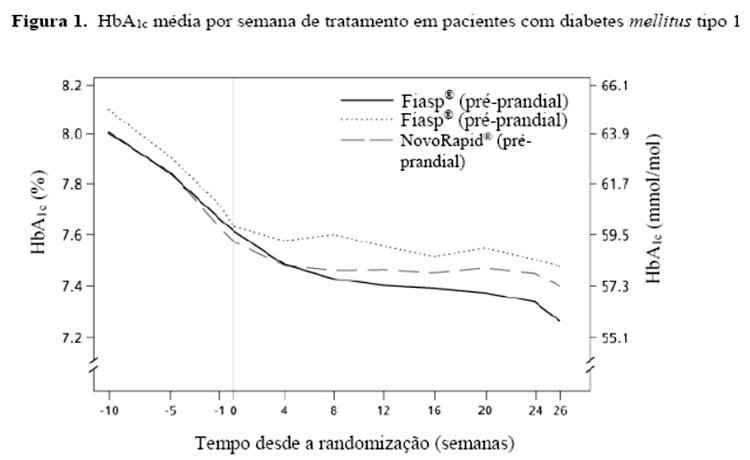
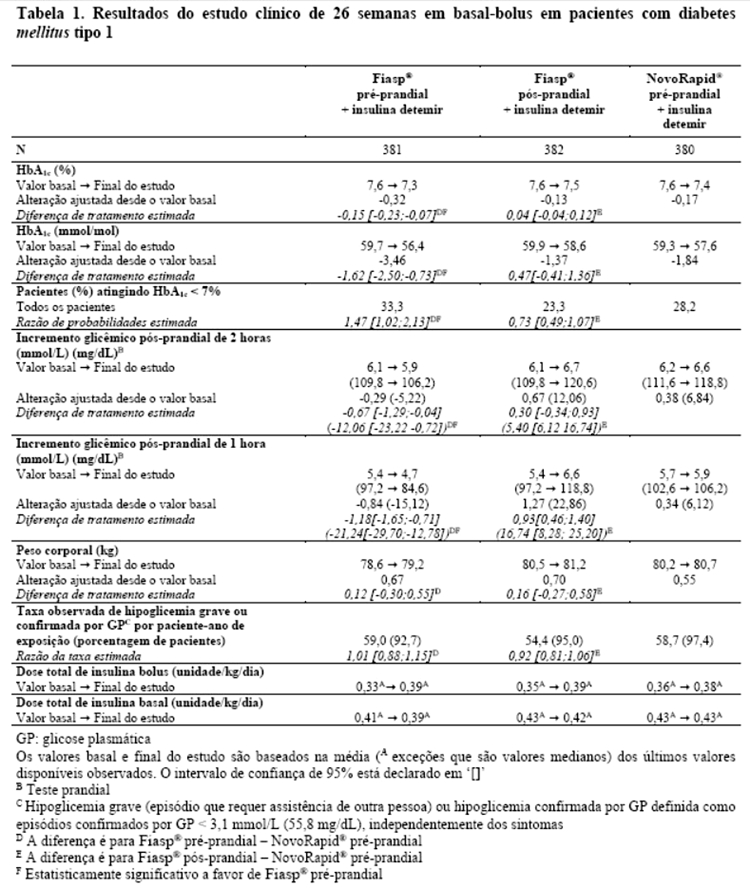
Em pacientes com diabetes mellitus tipo 1, Fiasp® proporcionou um maior controle glicêmico geral do que NovoRapid®. Fiasp® proporcionou um melhor controle glicêmico pós-prandial do que NovoRapid®, sem aumento no risco global de hipoglicemia grave ou confirmada em pacientes com diabetes mellitus tipo 1 ou tipo 2 (Tabela 1 e 2).
Pacientes com diabetes mellitus tipo 2:
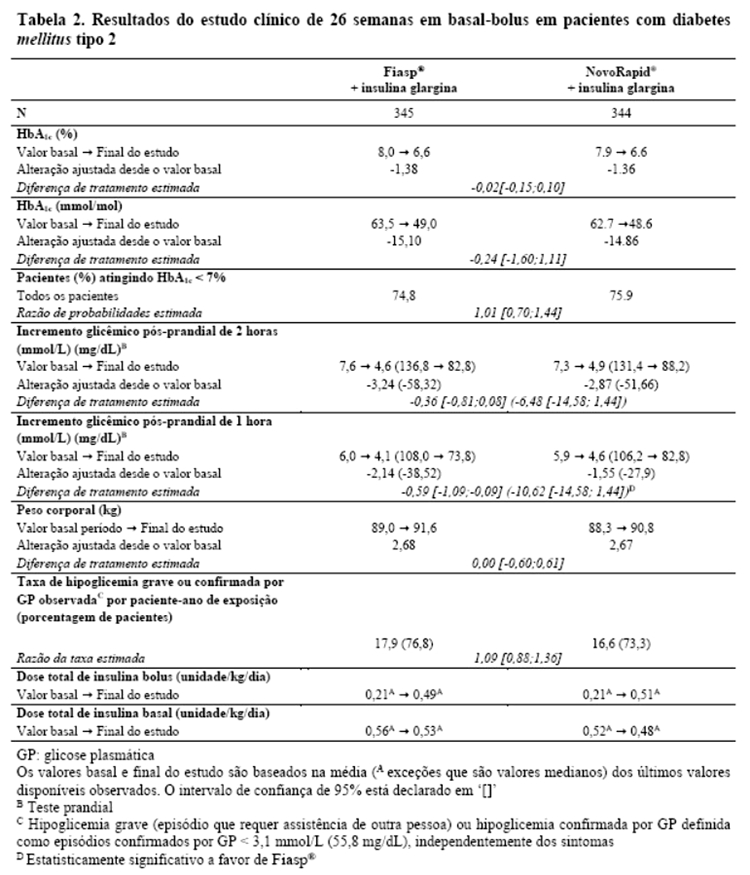
Fiasp® foi efetivo no controle glicêmico em pacientes com diabetes mellitus tipo 2 (Tabela 2).
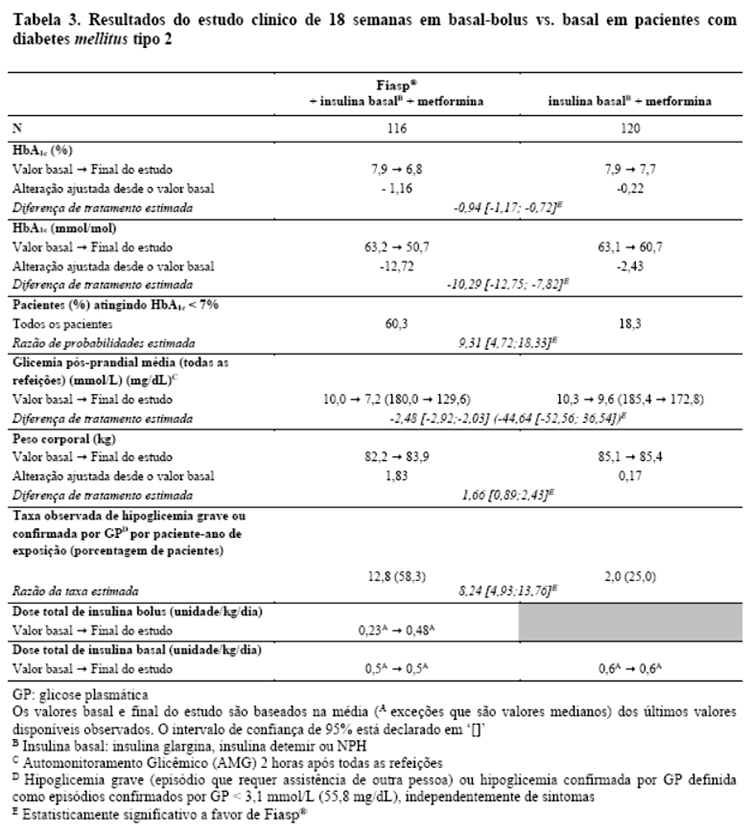
Fiasp® em combinação com insulina basal diária e metformina resultou em uma redução superior na HbA1c e uma redução estatisticamente significativa na glicemia pós-prandial em pacientes com diabetes mellitus tipo 2 em comparação à insulina basal diária com metformina (Tabela 3).
Idosos:
Nos três estudos clínicos controlados, 192 de 1219 (16%) pacientes com diabetes mellitus tipo 1 ou diabetes mellitus tipo 2 tratados com Fiasp® tinham ≥ 65 anos de idade e 24 de 1219 (2%) tinham ≥ 75 anos de idade. Nenhuma diferença geral na segurança ou eficácia foi observada entre pacientes idosos e mais jovens.
Infusão subcutânea contínua de insulina (CSII) (do inglês, Continuous Subcutaneous Insulin Infusion)
Um estudo de 6 semanas, randomizado (2:1), duplo-cego, de grupos paralelos com controle ativo avaliou a compatibilidade de Fiasp® e NovoRapid® administrados por meio do sistema CSII em pacientes adultos com diabetes mellitus tipo 1. Não houve episódios microscopicamente confirmados de oclusões no equipo de infusão nos grupos Fiasp® (n=25) ou NovoRapid® (n=12). Houve dois pacientes do grupo Fiasp® que relataram, cada um, duas reações no local de infusão decorrentes do tratamento.
• População pediátrica
A eficácia e segurança de Fiasp® foram avaliadas em um estudo clínico 1:1:1, randomizado, ativocontrolado, em crianças e adolescentes com diabetes mellitus tipo 1, entre 1 e 18 anos de idade, por um período de 26 semanas (n=777). Neste estudo, foram avaliadas a eficácia e segurança de Fiasp® administrado pré-prandial (0-2 minutos antes da refeição) ou pós-prandial (20 minutos após o início da refeição) e de NovoRapid® administrado pré-prandial, ambos em combinação com insulina degludeca. O desfecho primário foi a avaliação da alteração de HbA1c em relação ao valor basal 26 semanas após a randomização para todos os pacientes randomizados.
Este estudo clínico incluiu um período de triagem de 2 semanas, um período de "run-in" de 12 semanas (para otimização da insulina basal), um período de 26 semanas de tratamento e um período de 30 dias de acompanhamento. Durante o período de tratamento, a insulina em bolus foi titulada para o alvo glicêmico pré-prandial de 4,0-8,0 mmol/L (71-145 mg/dL) e alvo glicêmico na hora de dormir de 6,7-10,0 mmol/L (120-180 mg/dL), em uma abordagem de alvo de tratamento.
Os seguintes critérios de inclusão foram utilizados neste estudo clínico:
- Diagnóstico de DM1 (baseado em avaliação clínica e apoiado por análises laboratoriais de acordo com as diretrizes locais);
-Tratamento diário em andamento com um regime de insulina basal-bolus com uma insulina análoga basal ou NPH por pelo menos 90 dias antes da visita de triagem;
- HbA1c ≤9.5% (80 mmol/mol) analisado pelo laboratório central na visita de triagem.
Os pacientes no braço de Fiasp® pré-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 144 adolescentes entre 12 e 17 anos de idade. Os pacientes no braço de Fiasp® pós-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 143 adolescentes entre 12 e 17 anos de idade.
Fiasp® administrado pré-prandial demonstrou superioridade quando comparado a NovoRapid® em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: -0,17% [-0,30; -0,03] IC95%). Fiasp® administrado pós-prandial demonstrou não inferioridade quando comparado a NovoRapid®, em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: 0.13% [-0.01; 0.26] IC95%).
Foi observada diferença estatisticamente significativa a favor de Fiasp® administrado pré-prandial, quando comparado a NovoRapid® pré-prandial após 26 semanas, em relação ao nível basal de glicemia pós-prandial, 1 hora após o almoço e jantar. Para Fiasp® pós-refeição, foi observada diferença estatisticamente significativa a favor de NovoRapid® pré-prandial em relação a este parâmetro.
Não foi observado aumento geral do risco de hipoglicemia grave ou confirmada em comparação a NovoRapid®.
Os efeitos observados e os perfis de segurança foram comparáveis entre todos os grupos etários.
Referências:
1. Russell-Jones D, et al. Fast-Acting Insulin Aspart Improves Glycemic Control in Basal-Bolus Treatment for Type 1 Diabetes: Results of a 26-Week Multicenter, Active-Controlled, Treat-to-Target, Randomized, Parallel-Group Trial (onset 1). Diabetes Care 2017;40:943-950.
2. Bowering K, et al. Faster Aspart Versus Insulin Aspart as Part of a Basal-Bolus Regimen in Inadequately Controlled Type 2 Diabetes: The onset 2 Trial. Diabetes Care 2017;40:951-957.
3. Rodbard HW, et al. Adding fast-acting insulin aspart to basal insulin significantly improved glycaemic control in patients with type 2 diabetes: A randomized, 18-week, open-label, phase 3 trial (onset 3). Diabetes Obes Metab 2017;19:1389-1396.
4. Zijlstra E, et al. Investigation of Pump Compatibility of Fast-Acting Insulin Aspart in Subjects With Type 1 Diabetes. J Diabetes Sci Technol 2018;12(1):145-151.
5. Bode BW, et al. Efficacy and Safety of Fast-Acting Insulin Aspart Compared With Insulin Aspart, Both in Combination With Insulin Degludec, in Children and Adolescents With Type 1 Diabetes: The onset 7 Trial. Diabetes Care 2019;42(7):1255-1262.
3. CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismo de ação
A atividade primária de Fiasp® é a regulação do metabolismo da glicose.
As insulinas, incluindo insulina asparte, princípio ativo de Fiasp® , exercem a sua ação específica por meio da ligação aos receptores da insulina. A insulina ligada ao receptor reduz a glicemia facilitando a captação celular de glicose no músculo esquelético e no tecido adiposo, e inibindo a saída de glicose do fígado.
A insulina inibe a lipólise no adipócito, inibe a proteólise e aumenta a síntese de proteína.
Dados Farmacodinâmicos
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início de ação mais rápido e maior efeito hipoglicemiante inicial em comparação com NovoRapid®. Isso deve ser considerado ao prescrever Fiasp®.
O início de ação foi 5 minutos mais rápido e o tempo para a taxa de infusão máxima de glicose foi 11 minutos mais curto com Fiasp® do que com NovoRapid®. O efeito hipoglicêmico (AUCGIR) foi 74% maior durante os primeiros 30 minutos com Fiasp® do que com NovoRapid®. O efeito hipoglicemiante total e o efeito hipoglicemiante máximo (GIRmax) foram comparáveis entre Fiasp® e NovoRapid®.
O efeito hipoglicemiante total e o efeito hipoglicemiante máximo de Fiasp® aumentam linearmente com o aumento da dose dentro da faixa de dose terapêutica.
A duração de ação foi mais curta e o efeito hipoglicemiante tardio foi 10% menor para Fiasp® comparado com aquele de NovoRapid®.
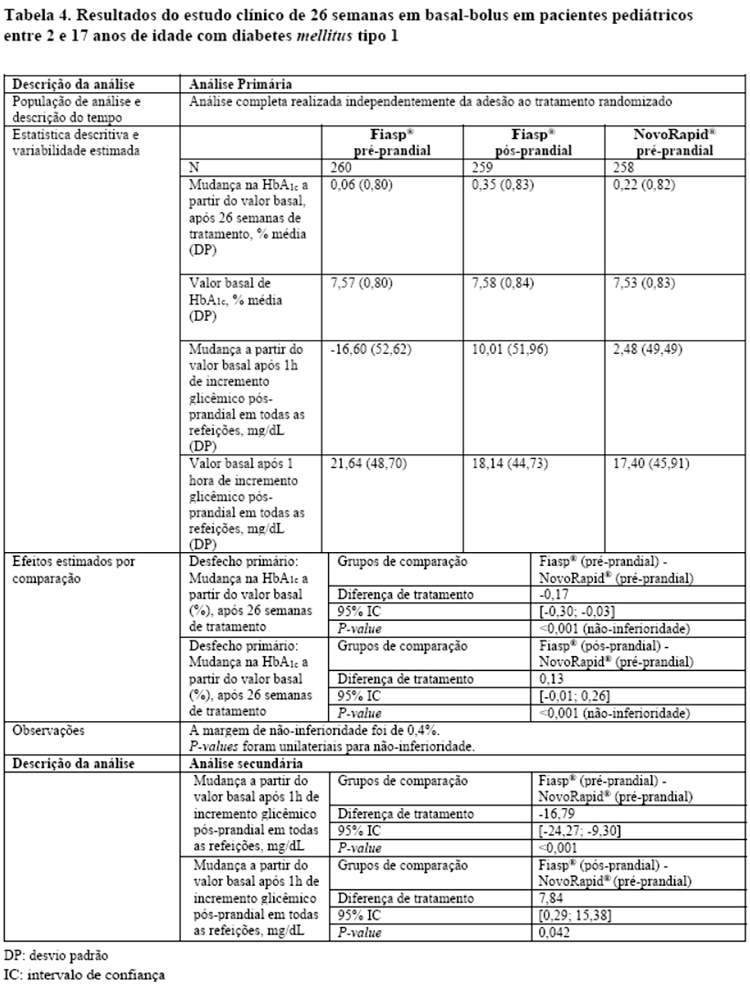
Fiasp® injetado pré-prandial produziu um efeito hipoglicemiante pós-prandial significativamente maior após um teste prandial padronizado em comparação com NovoRapid®. A diferença de tratamento na redução do incremento glicêmico pós-prandial de 2 horas foi estatisticamente significativa em favor de Fiasp® (-0,67 mmol/L [-1,29; -0,04] IC95%) (-12,06 mg/dL [23,22; -072] IC95%). A diferença de tratamento na redução do incremento glicêmico pós-prandial de 1 hora foi de -1,18 mmol/L [-1,65; -0,71] IC95% (-21,24 mg/dL [-29,70; -12,78] IC95%), consistente com o perfil de absorção mais rápido (vide Tabela 1, na seção "2. Resultados de eficácia" e Figura 2).
A variabilidade diária intraindividual no efeito hipoglicemiante foi baixa para Fiasp® para o efeito hipoglicemiante inicial (AUCGIR, 0-1h, CV~26%), total (AUCGIR, 0-12h, CV~18%) e máximo (GIRmax, CV 19%).
Infusão subcutânea contínua de insulina (CSII)
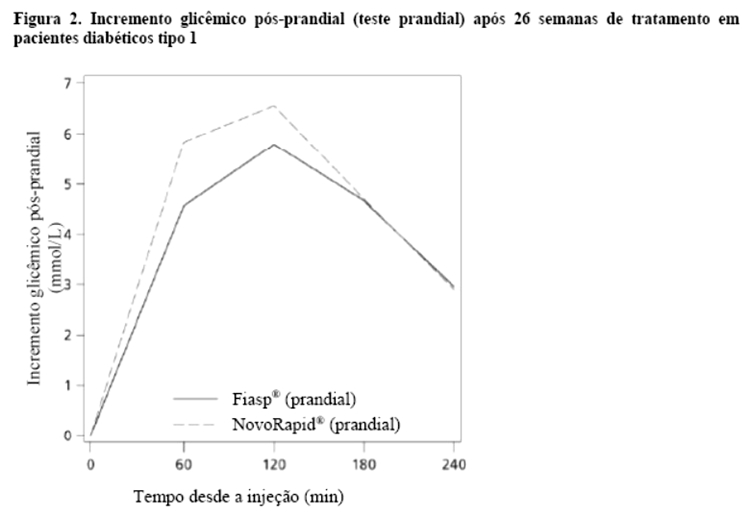
Fiasp® mostrou um efeito hipoglicemiante pós-prandial maior após um teste prandial padronizado com relação à resposta PPG (do inglês, Post-Prandial blood Glucose) de 1 hora e 2 horas (diferença de tratamento: -0,50 mmol/L [-1,07; 0,07] IC 95% (-9.00 mg/dL [-30.60; 1.26] IC95%) e -0,99 mmol/L [-1,95; -0,03] IC 95% (-17.82 mg/dL [-35.10; -0.54] IC95%), respectivamente em comparação com NovoRapid® (Figura 3) em um contexto de CSII.
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de ação mais rápido e um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo semelhante em comparação com NovoRapid®.
O efeito hipoglicemiante total e máximo com Fiasp® foi comparável entre idosos e mais jovens.
Obesidade:
O efeito do IMC na farmacodinâmica de Fiasp® foi explorado em uma análise transversal de estudos farmacodinâmicos. Fiasp® teve um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo comparável a NovoRapid® nos níveis de IMC em pacientes com diabetes mellitus tipo 1.
Uma tendência para redução no efeito hipoglicemiante de Fiasp® com o aumento no IMC foi observada em pacientes com diabetes mellitus tipo 1.
Propriedades Farmacocinéticas
Absorção:
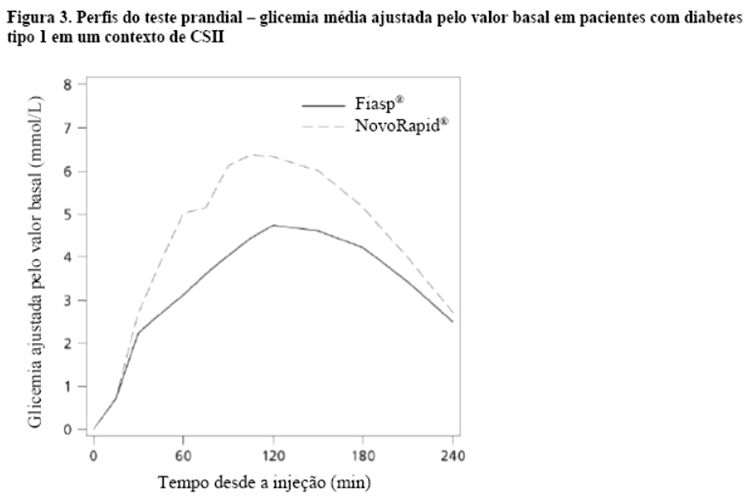
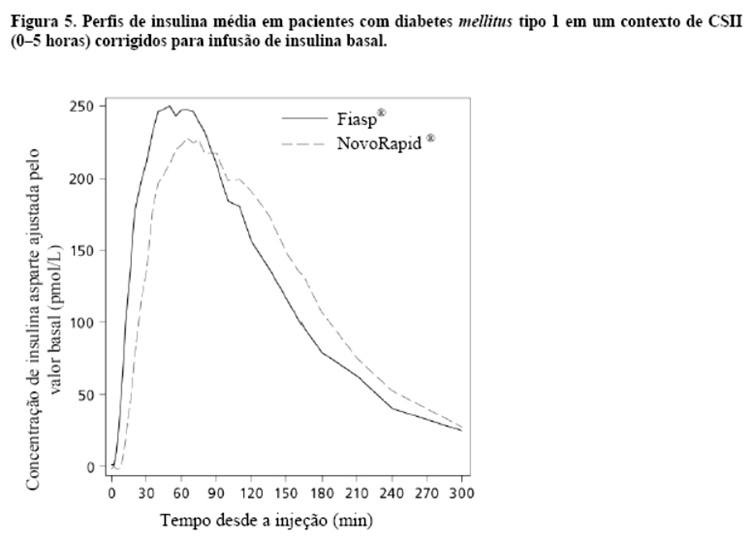
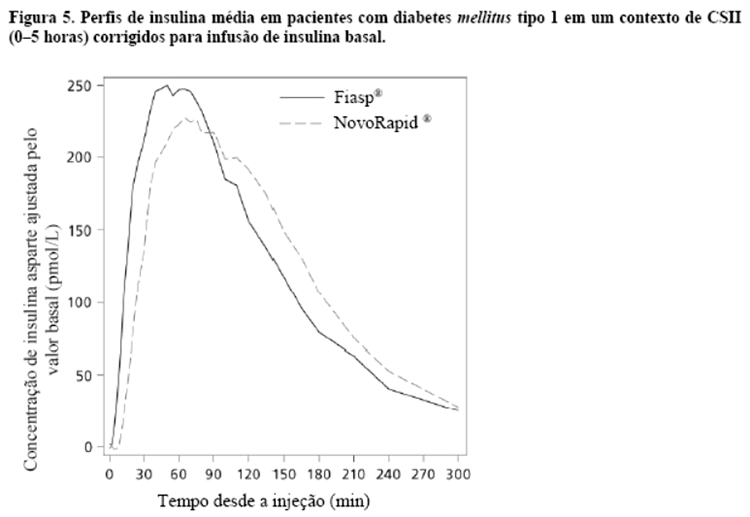
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início mais rápido de exposição e maior exposição inicial à insulina após a administração em bolus por meio da injeção subcutânea (Figura 4, Tabela 4) ou por meio de CSII em bombas (Figura 5) em comparação com NovoRapid®.
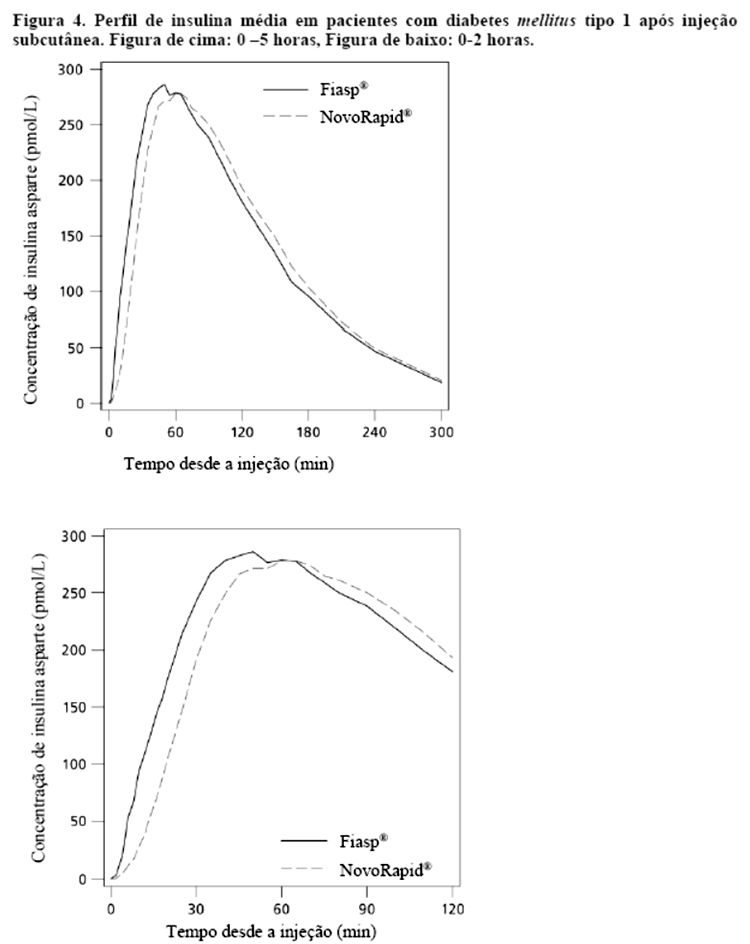
Após administração de Fiasp®, a insulina apareceu na circulação aproximadamente 4 minutos após a administração. O início do aparecimento foi duas vezes mais rápido (correspondendo a 5 minutos mais cedo), o tempo até 50% da concentração máxima foi 9 minutos mais curto com Fiasp® comparado a NovoRapid® com o dobro da insulina disponível durante os primeiros 30 minutos (Tabela 5). A exposição total à insulina (AUCinsulina asparte, 0-12horas) e a concentração máxima de insulina (Cmax) foram comparáveis entre Fiasp® e NovoRapid®. A exposição total e a concentração máxima de insulina aumentam de maneira proporcional com o aumento da dose subcutânea de Fiasp® dentro da faixa de dose terapêutica.

Infusão subcutânea contínua de insulina (CSII):
O início da exposição em um contexto de CSII (tempo até atingir a concentração máxima) foi 26 minutos mais curto com Fiasp® em comparação a NovoRapid®, resultando em aproximadamente três vezes mais insulina disponível durante os primeiros 30 minutos (Figura 5). A duração da exposição (tempo de atraso 50% Cmax) foi 35 minutos mais curta com Fiasp® comparado a NovoRapid®.
Distribuição:
A insulina asparte possui uma baixa afinidade de ligação a proteínas plasmáticas ( < 10%), semelhante àquela observada com a insulina humana regular.
Biotransformação:
A degradação de insulina asparte é semelhante àquela da insulina humana.
Eliminação:
A meia-vida após a administração subcutânea de Fiasp® é de 57 minutos e comparável à de NovoRapid®.
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de exposição mais rápido e uma exposição à insulina inicial maior, mantendo uma exposição total e uma concentração máxima semelhantes, comparada com NovoRapid®.
O efeito da idade na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Não foi observada relação entre exposição total à insulina de Fiasp® e idade (faixa etária entre 18-83 anos).
Sexo:
O efeito do sexo na farmacocinética de Fiasp® foi avaliado cruzando-se os dados de todos os estudos de farmacocinética. Fiasp® mostrou um início de exposição mais rápido comparável e uma exposição à insulina inicial mais alta, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid® para pacientes do sexo feminino e masculino com diabetes mellitus tipo 1.
A exposição inicial e máxima à insulina de Fiasp® foi comparável entre pacientes do sexo feminino e masculino com diabetes mellitus tipo 1. No entanto, a exposição total à insulina foi maior em pacientes do sexo feminino em comparação à do sexo masculino com diabetes mellitus tipo 1.
Obesidade:
O efeito do IMC na farmacocinética de Fiasp® foi explorado em uma análise cruzada de estudos farmacocinéticos. Para pacientes com diabetes mellitus tipo 1, a maior exposição inicial à insulina para Fiasp® comparada a NovoRapid® foi conservada nos níveis de IMC e esta diferença de tratamento aumentou com o aumento do IMC. A exposição total e máxima à insulina foi comparável entre Fiasp® e NovoRapid® nos níveis de IMC.
O efeito do IMC na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Nenhuma relação entre exposição total à insulina de Fiasp® e IMC foi observada.
Raça e Etnia:
O efeito da raça e etnia (negros versus brancos e hispânicos versus não hispânicos) na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Para Fiasp®, nenhuma diferença em exposição foi encontrada entre os grupos raciais e étnicos investigados.
Insuficiência hepática:
Um estudo de farmacocinética de dose única de insulina asparte foi realizado em 24 indivíduos com função hepática variando de normal a gravemente comprometida. Em participantes do estudo com comprometimento hepático, a taxa de absorção foi reduzida e mais variável.
Insuficiência renal:
O efeito do comprometimento renal na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. A função renal foi definida usando-se clearance de creatinina (CLcr) como segue: ≥90 mL/min (normal)(N=546), 60-89 mL/min (leve)(N=115), 30-59 mL/min (moderado)(N=21). A exposição total mais alta foi observada com decréscimo na função renal para Fiasp®. No entanto, houve alguma variabilidade entre participantes do estudo na exposição total nos pacientes com diabetes mellitus tipo 1 com comprometimento renal leve ou moderado. Portanto, como com todas as insulinas, o monitoramento glicêmico deve ser intensificado e a dose de Fiasp® ajustada individualmente em pacientes com insuficiência renal.
População pediátrica:
Em crianças (6-11 anos) e adolescentes (12-18 anos), Fiasp® mostrou um início mais rápido de exposição e uma exposição inicial mais alta à insulina, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid®.
O início de ação e a exposição inicial a Fiasp® foram similares entre crianças, adolescentes e adultos. A exposição total a Fiasp® foi menor em crianças e adolescentes em comparação com adultos quando administradas 0,2 unidades/kg de peso corporal, enquanto a concentração plasmática máxima de insulina asparte foi similar entre todos os grupos etários
Dados de segurança pré-clínico
Dados não clínicos não revelaram risco especial para seres humanos com base nos estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade e toxicidade de reprodução após a exposição à insulina asparte.
Em testes in vitro, incluindo ligação à insulina, sítios de receptor de IGF-1 e efeitos no crescimento celular, a insulina asparte se comportou de uma maneira semelhante à insulina humana. Estudos também demonstram que a dissociação da ligação da insulina asparte ao receptor de insulina é equivalente a da insulina humana.
4. CONTRAINDICAÇÕES
- Hipersensibilidade a substância ativa ou a qualquer um dos excipientes (vide seção "Composição");
- Pacientes apresentando sintomas de hipoglicemia (vide seção "9. Reações Adversas").
5. ADVERTÊNCIAS E PRECAUÇÕES
Antes de viajar entre zonas de fuso horário diferente, o paciente deve procurar orientação médica, já que isso pode significar que o paciente deve usar a insulina e fazer as refeições em períodos diferentes.
Hipoglicemia:
A omissão de uma refeição ou exercício físico não planejado e extenuante pode levar à hipoglicemia.
A hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina (vide seção "9. Reações Adversas" e "10. Superdose").
Os pacientes cujo controle glicêmico é amplamente melhorado, por exemplo, pela insulinoterapia intensificada, podem apresentar uma alteração nos seus sintomas habituais de alerta da hipoglicemia, e devem ser aconselhados de acordo. Os sintomas habituais de alerta podem desaparecer em pacientes com diabetes mellitus de longa data.
O momento da hipoglicemia geralmente reflete o perfil de tempo-ação da formulação da insulina administrada. Fiasp® possui um perfil de tempo de ação distinto (vide seção "Mecanismo de ação") o que impacta o momento da hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que se ocorrer a hipoglicemia, ela pode ocorrer mais cedo após uma injeção/infusão quando comparado com outras insulinas prandiais.
Como Fiasp® deve ser administrado no início de uma refeição ou no pós-prandial (dentro de 20 minutos após iniciar uma refeição), o rápido início de ação deve, portanto, ser considerado em pacientes com esvaziamento gástrico atrasado.
Este medicamento não deve ser usado enquanto o paciente apresentar sintomas de hipoglicemia.
População pediátrica
O monitoramento rigoroso da glicemia é recomendado se este medicamento for administrado após o início da última refeição do dia, para evitar hipoglicemia noturna
Hiperglicemia:
O uso de doses inadequadas ou a descontinuação do tratamento, especialmente em pacientes que necessitam de insulina, pode levar à hiperglicemia e à cetoacidose diabética, condições que são potencialmente letais.
Infusão subcutânea contínua de insulina (CSII):
Defeitos na bomba ou no equipamento de infusão podem levar a um início rápido de hiperglicemia e cetose. A identificação imediata e a correção da causa da hiperglicemia ou cetose são necessárias. Terapia interina com injeção subcutânea pode ser necessária.
Doenças concomitantes:
Doenças concomitantes renais, hepáticas ou que afetam as glândulas suprarrenal, hipófise ou tireoide podem exigir modificações na dose de insulina.
Transferência de outras insulinas:
Vide seção "8. Posologia e modo de usar".
Em combinação com tiazolidinedionas e insulinas:
Casos de insuficiência cardíaca congestiva foram relatados quando as tiazolidinedionas foram usadas em combinação com insulina, especialmente em pacientes com fatores de risco para o desenvolvimento de insuficiência cardíaca congestiva. Isto deve ser considerado se o tratamento com a combinação de tiazolidinedionas e insulina for considerado. Se a combinação for usada, os pacientes devem ser observados para sinais e sintomas de insuficiência cardíaca congestiva, ganho de peso e edema. Tiazolidinedionas devem ser descontinuadas se ocorrer qualquer deterioração nos sintomas cardíacos.
Iniciação da insulina e intensificação do controle glicêmico:
A intensificação ou melhora rápida no controle glicêmico foi associada a um transtorno transitório e reversível de refração oftalmológica, piora da retinopatia diabética, neuropatia periférica aguda dolorosa e edema periférico. No entanto, o controle glicêmico de longo prazo reduz o risco de retinopatia e neuropatia diabética.
Anticorpos contra insulina:
A administração de insulina pode causar a formação de anticorpos contra insulina. Em casos raros, a presença de tais anticorpos contra insulina pode ocasionar a necessidade de ajuste da dose de insulina para corrigir uma tendência para hiper ou hipoglicemia.
Prevenção de misturas acidentais/erros de medicação:
Os pacientes devem ser instruídos a verificar sempre o rótulo da insulina antes de cada injeção para evitar misturas acidentais entre Fiasp® outras insulinas.
Os pacientes devem verificar visualmente as unidades da dose antes da administração de Fiasp®. Portanto, o requisito para a autoadministração por pacientes é que eles possam ler a escala de dose. Os pacientes que são cegos ou têm pouca visão devem ser instruídos a sempre obter assistência de outra pessoa que tenha boa visão e esteja treinada na administração de insulinas.
Efeitos na capacidade de dirigir e operar máquinas:
A capacidade do paciente de se concentrar e reagir podem ser prejudicadas como resultado da hipoglicemia. Isto pode constituir um risco em situações em que essas habilidades sejam de importância especial (por exemplo, dirigir um carro ou operar máquinas).
Os pacientes devem ser aconselhados a tomar precauções para evitar a hipoglicemia ao dirigir. Isto é particularmente importante para aqueles que têm pouco ou nenhum conhecimento dos sinais de alerta para hipoglicemia ou que têm episódios frequentes de hipoglicemia. A conveniência de dirigir deve ser considerada nessas circunstâncias.
Informações referentes à fertilidade, gravidez e amamentação
Fertilidade:
Estudos de reprodução em animais não revelaram diferenças entre a insulina asparte e a insulina humana em relação à fertilidade.
Gravidez:
Não há dados disponíveis com o uso de Fiasp® em mulheres grávidas para informar um risco associado ao medicamento para defeitos congênitos maiores e aborto. Informações disponíveis de estudos randomizados-controlados com o uso de insulina asparte durante o segundo trimestre de gravidez não demonstraram uma associação entre a insulina asparte e defeitos congênitos maiores, desfechos adversos materno ou desfechos adversos fetais. Existem riscos para a mãe e o feto associados ao diabetes mal controlado na gravidez.
O controle glicêmico intensificado e o monitoramento de mulheres grávidas com diabetes mellitus (diabetes mellitus tipo 1, diabetes mellitus tipo 2 ou diabetes mellitus gestacional) são recomendados durante toda a gravidez e quando pretende-se engravidar. As necessidades de insulina geralmente diminuem no primeiro trimestre e aumentam subsequentemente durante o segundo e terceiro trimestre. Após o parto, normalmente as necessidades de insulina retornam rapidamente aos valores pré-gestacionais.
Categoria de risco na gravidez:
A Este medicamento pode ser utilizado durante a gravidez desde que sob prescrição médica ou do cirurgião-dentista.
Amamentação:
Não existem restrições no tratamento com Fiasp® durante a amamentação. O tratamento da mãe lactante com insulina não apresenta risco ao bebê. No entanto, a dose de Fiasp® pode precisar ser ajustada.
Este medicamento pode causar doping.
6. INTERAÇÕES MEDICAMENTOSAS
Alguns medicamentos são conhecidos por interagir com o metabolismo da glicose.
As substâncias a seguir podem reduzir a necessidade de insulina:
Medicamentos antidiabéticos orais, inibidores da monoaminoxidase (IMAO), betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), salicilatos, esteroides anabolizantes, sulfonamidas e agonista do receptor de GLP-1.
As substâncias a seguir podem aumentar a necessidade de insulina:
Contraceptivos orais, tiazidas, glicocorticoides, hormônios tireoidianos, simpatomiméticos, hormônio do crescimento e danazol.
Os agentes betabloqueadores podem mascarar os sintomas da hipoglicemia.
A octreotida/lanreotida podem aumentar ou diminuir as necessidades de insulina.
O álcool pode intensificar ou reduzir o efeito hipoglicêmico da insulina.
7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Antes do primeiro uso:
Armazenar sob refrigeração (entre 2°C e 8°C). Mantenha distante do compartimento do congelador. Não congelar. Mantenha o frasco-ampola na embalagem para protegê-lo da luz.
Este medicamento tem prazo de validade de 30 meses.
Após o primeiro uso ou carregado como reserva:
Válido por 4 semanas, quando armazenado em temperaturas de até 30°C ou sob refrigeração (entre 2°C e 8°C). Não congelar. Mantenha o frasco-ampola na embalagem para protegê-lo da luz.
Não armazene o produto sob temperaturas acima de 30°C.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Número de lote e datas de fabricação e validade: vide embalagem.
A data de validade se refere ao último dia do mês indicado.
Fiasp® é uma solução aquosa injetável límpida e incolor.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
8. POSOLOGIA E MODO DE USAR
Método de administração:
Fiasp® está disponível em frasco-ampola e deve ser injetado com o auxílio de seringas de insulina com unidades de escala (100U ou 100 U/mL).
Injeção subcutânea:
Fiasp® é administrado pela via subcutânea na parede abdominal, na parte superior do braço ou na coxa. Os locais de injeção devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia.
A duração da ação de Fiasp® pode variar de acordo com a dose, local da injeção, fluxo sanguíneo, temperatura e nível de atividade física.
Infusão subcutânea contínua de insulina (CSII):
Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas adequadas para infusão de insulina. Fiasp® pode ser administrado de acordo com as instruções fornecidas pelo fabricante da bomba, de preferência no abdômen. Os locais de infusão devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia. Quando usado com uma bomba de infusão de insulina, Fiasp® não deve ser diluído ou misturado com outras insulinas.
Os pacientes que usam CSII devem ser orientados sobre o uso da bomba com o reservatório e tubo corretos. O equipo de infusão (tubo e cânula) deve ser trocado de acordo com as instruções do produto fornecidas com o equipo de infusão.
Pacientes que administram Fiasp® por CSII devem ser treinados para administrar insulina por injeção e ter a insulinoterapia alternativa disponível em caso de falha da bomba.
Uso intravenoso:
Se necessário, Fiasp® pode ser administrado pela via intravenosa por profissionais de saúde.
Para uso intravenoso, Fiasp® deve ser usado em concentrações de 0,5 unidade/mL a 1,0 unidade/mL de insulina asparte em sistemas de infusão usando bolsas de infusão de polipropileno. Fiasp® demonstrou ser estável em temperatura ambiente por 24 horas nos líquidos de infusão, como cloreto de sódio 0,9% ou dextrose 5%. O monitoramento da glicemia é necessário durante a infusão de insulina. Deve-se tomar cuidado para assegurar que a insulina seja injetada na bolsa de infusão e não simplesmente no acesso de entrada da bomba.
Não há dados de segurança e eficácia da utilização intravenosa de Fiasp® em crianças.
Precauções especiais para manuseio e descarte:
As agulhas e as seringas não devem ser compartilhadas.
Fiasp® não deve ser usado se a solução não estiver límpida e incolor.
Fiasp® não deve ser usado se foi congelado.
O paciente deve descartar a agulha após cada aplicação.
Qualquer resíduo deve ser descartado de acordo com as exigências locais.
Incompatibilidades:
Substâncias adicionadas a Fiasp® podem causar a degradação da insulina asparte. Fiasp® não deve ser diluído ou misturado com outros medicamentos, exceto em casos de fluídos para infusão, conforme descrito no item "Mètodo de administração".
Posologia:
Fiasp® é uma insulina para administração subcutânea pré-prandial ou pós-prandial (em até 20 minutos após iniciar uma refeição). Além disso, Fiasp® pode ser usado em infusão subcutânea contínua de insulina (CSII) em bombas de infusão ou ser administrado por via intravenosa por profissionais de saúde.
A potência dos análogos da insulina, incluindo Fiasp®, é expressa em unidades. Uma (1) unidade de Fiasp® corresponde a 1 unidade internacional de insulina humana ou 1 unidade de outros análogos da insulina de ação rápida.
A posologia de Fiasp® é individual e determinada de acordo com as necessidades do paciente.
- Terapia por injeção: Fiasp® deve ser usada em combinação com insulina de ação intermediária ou longa administrada pelo menos uma vez ao dia. Em um regime de tratamento basal-bolus, aproximadamente 50% desta necessidade pode ser fornecida por Fiasp® e o restante pela insulina de ação intermediária ou longa.
- CSII: Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas. Neste caso, Fiasp® cobrirá a necessidade para da insulina bolus (aproximadamente 50%) e da insulina basal.
O monitoramento da glicemia e o ajuste na dose de insulina são recomendados para atingir o controle glicêmico ideal.
A necessidade individual de insulina diária total em adultos, adolescentes e crianças pode variar e é geralmente entre 0,5 e 1,0 unidade/kg/dia.
O ajuste da dose pode ser necessário se os pacientes aumentarem a atividade física, modificarem a sua dieta habitual ou durante doença concomitante. Os níveis glicêmicos devem ser monitorados de modo adequado sob essas condições.
O início de ação mais rápido deve ser considerado ao prescrever Fiasp® (vide seção "3. Características farmacológicas").
Iniciação
Pacientes com diabetes mellitus tipo 1:
A dose inicial recomendada de Fiasp® em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina é de aproximadamente 50% da dose total de insulina diária e deve ser dividida entre cada refeição diária. O restante da dose total de insulina diária deve ser administrado como insulina de ação intermediária ou longa. Como regra geral, 0,2 a 0,4 unidades de insulina por quilograma de peso corporal podem ser usadas para calcular a dose inicial de insulina diária total em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina.
Pacientes com diabetes mellitus tipo 2:
A dose inicial sugerida é de 4 unidades em uma ou mais refeições. O número de injeções e a titulação subsequente dependerão do alvo glicêmico individual.
Transferência de outra insulina
Recomenda-se o monitoramento glicêmico rigoroso durante a transferência de outras insulinas para uso na hora da refeição e nas semanas iniciais seguintes.
A conversão de outra insulina para uso na hora da refeição pode ser feita unidade por unidade. Devido ao início mais rápido de ação da insulina, Fiasp® deve ser injetado no início de uma refeição ou depois (em até 20 minutos após o início de uma refeição).
A transferência de um paciente de outro tipo, marca ou fabricante de insulina para Fiasp® deve ser feita sob supervisão médica e pode resultar na necessidade para uma modificação na dose.
Doses e horários das insulinas de ação intermediária ou longa concomitantes ou outro tratamento antidiabético concomitante podem precisar ser ajustados.
Pacientes com diabetes mellitus tipo 2
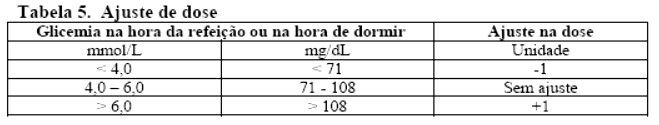
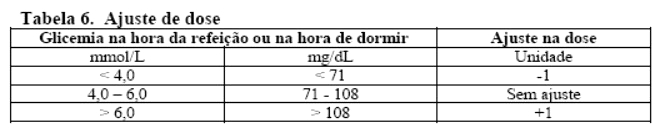
O ajuste de Fiasp® pode ser considerado diariamente com base no AMG (Automonitoramento Glicêmico) na hora da refeição e na hora de dormir do dia anterior de acordo com a Tabela 5.
• O Fiasp® pré-desjejum deve ser ajustado de acordo com o AMG pré-almoço do dia anterior.
• O Fiasp® pré-almoço deve ser ajustado de acordo com o AMG pré-jantar do dia anterior.
• O Fiasp® pré-jantar deve ser ajustado de acordo com o AMG na hora de dormir no dia anterior.
Idosos (≥ 65 anos de idade)
A segurança e eficácia de Fiasp® foram estabelecidas em pacientes idosos. Recomenda-se o monitoramento rigoroso da glicemia, e a dose de insulina deve ser ajustada individualmente (Vide seção "3. Características Farmacológicas" e seção "2. Resultados de Eficácia").
Insuficiência renal e hepática
A insuficiência renal ou hepática pode reduzir as necessidades de insulina do paciente. Em pacientes com insuficiência renal ou hepática, o monitoramento glicêmico deve ser intensificado e a dose ajustada individualmente (vide seção "3. Características Farmacológicas").
População pediátrica
Fiasp® pode ser usado por adolescentes e crianças a partir de 1 ano de idade (vide seção "2. Resultados de eficácia"), substituindo a insulina humana regular quando um início de ação rápido for necessário, por exemplo, nos horários de aplicação da insulina prandial (vide seção "3. Características farmacológicas", itens "Propriedade farmacodinâmicas" e "Propriedades farmacocinéticas"). Fiasp® não foi avaliado para uso em crianças abaixo de 1 ano de idade e em crianças com diabetes mellitus tipo 2.
Não há experiência clínica com o uso de Fiasp® em crianças menores de 2 anos de idade.
Recomenda-se que Fiasp® seja administrado antes da refeição (0-2 minutos), com a flexibilidade de administrar em até 20 minutos após o início da refeição, quando existe incerteza sobre o consumo alimentar
Dose esquecida
Pacientes em tratamento basal-bolus que esqueceram uma dose na hora da refeição devem ser aconselhados a monitorar o seu nível glicêmico para decidir se uma dose de insulina é necessária. Os pacientes devem retomar o seu esquema habitual de dose na próxima refeição.
9. REAÇÕES ADVERSAS
As reações adversas listadas nesta seção são consideradas esperadas para este medicamento.
Resumo do perfil de segurança
A reação adversa relatada com mais frequência durante o tratamento foi a hipoglicemia (vide item "Descrição das reações adversas selecionadas").
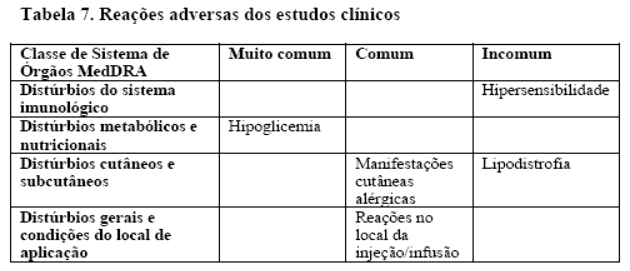
Reações adversas de estudos clínicos
As reações adversas listadas a seguir são baseadas em dados de seis estudos confirmatórios terapêuticos em adultos. Fiasp® foi comparado a NovoRapid® em cinco destes estudos, e comparado com insulina basal somente em um estudo. Nos seis estudos, 2163 pacientes foram tratados com Fiasp®; 1707 com diabetes mellitus tipo 1, dos quais 261 usando CSII, e 456 com diabetes mellitus tipo 2 (vide seção "2. Resultados de eficácia" para mais detalhes sobre os estudos). As reações adversas são classificadas de acordo com a Classe de Sistemas de Órgãos MedDRA. As categorias de frequência são definidas de acordo com a seguinte convenção: Muito comum (≥ 1/10); comum (≥ 1/100 a < 1/10); incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10,000 a < 1/1,000); muito rara ( < 1/10,000) e frequência desconhecida (não pode ser estimada com os dados disponíveis).
Descrição das reações adversas selecionadas
Reações alérgicas
Manifestações cutâneas alérgicas relatadas com Fiasp® (1,8% vs. 1,5% para comparador) incluem eczema, erupção cutânea, erupção cutânea prurítica, urticária e dermatite.
Com Fiasp®, reações de hipersensibilidade generalizada (manifestadas por erupção cutânea generalizada e edema facial) foram relatadas como incomum (0,2% vs. 0,3% para comparador). Com base nos dados obtidos após comercialização, formas graves de reações alérgicas sistêmicas podem ocorrer. Reações alérgicas do tipo imediato à insulina em si ou aos excipientes podem potencialmente ser de risco à vida.
Hipoglicemia
Hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina. Hipoglicemia grave pode levar à incon
sciência e/ou convulsões e pode resultar em comprometimento temporário ou permanente da função cerebral ou até mesmo morte. Os sintomas de hipoglicemia geralmente ocorrem repentinamente. Eles podem incluir suores frios, pele pálida fria, fadiga, nervosismo ou tremor, ansiedade, cansaço ou fraqueza incomum, confusão, dificuldade de concentração, sonolência, fome excessiva, alterações de visão, cefaleia, náusea e palpitação. O tempo de hipoglicemia geralmente reflete o perfil tempo-ação da formulação de insulina administrada. Fiasp® possui um perfil de ação diferenciado (vide seção "Propriedades Farmacocinéticas/Propriedades Farmacodinâmicas"), que afeta o tempo de hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que, se houver hipoglicemia, pode ocorrer mais cedo após uma injeção/infusão de Fiasp® em comparação com outras insulinas prandiais.
Lipodistrofia
Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) foi relatada no local da injeção/infusão em pacientes tratados com Fiasp® (0,5% vs. 0,2% no comparador). A rotação contínua do local da injeção dentro de uma mesma região em particular pode ajudar a reduzir o risco de desenvolver essas reações.
Reações no local da aplicação
Reações no local da injeção (incluindo erupção cutânea, rubor, inflamação, dor e hematoma) foram relatadas em pacientes tratados com Fiasp® (1,3% vs. 1,0% no comparador). Reações no local da infusão (incluindo rubor, inflamação, irritação, dor, hematoma e coceira) foram relatadas em pacientes tratados com Fiasp® (10,0% vs 8,3% no comparador). Essas reações são geralmente leves e transitórias e normalmente desaparecem durante o tratamento continuado.
População pediátrica
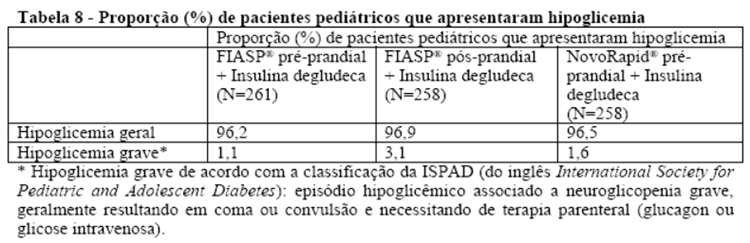
A eficácia e segurança foram investigadas em um estudo terapêutico confirmatório com crianças de 2 a 18 anos de idade, com diabetes mellitus tipo 1. No estudo, 519 pacientes foram tratados com Fiasp®. No geral, a frequência, o tipo e a gravidade das reações adversas na população pediátrica não indicaram diferenças quanto à experiência na população adulta. Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) no local da injeção foi relatada mais frequentemente no estudo com pacientes pediátricos em comparação com os estudos com adultos (veja acima). Na população pediátrica, lipodistrofia foi relatado com frequência de 2,1% para pacientes em uso de Fiasp® versus 1,6% para pacientes em uso de NovoRapid®
Outras populações especiais
Com base nos resultados de estudos clínicos, a frequência, tipo e gravidade das reações adversas observadas em pacientes idosos e em pacientes com comprometimento renal ou hepático não indicam diferenças na experiência mais ampla na população geral. Fiasp® foi administrado a pacientes idosos para investigação das propriedades farmacocinéticas (vide seção "3. Características Farmacológicas").
Imunogenicidade
Como para todas as terapias derivadas de proteínas, existe um potencial de imunogenicidade. A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do teste e pode ser influenciada por diversos fatores, como: metodologia do teste, manuseio da amostra, tempo de coleta da amostra, medicação concomitante e doença pré-existente. Por estes motivos, a comparação da incidência de anticorpos contra Fiasp® nos estudos descritos abaixo com a incidência de anticorpos em outros estudos ou contra outros produtos pode ser enganosa.
Em um estudo de 26 semanas com pacientes adultos com diabetes tipo 1, entre os 763 pacientes que receberam Fiasp®, 97,2% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 90,3% que resultaram positivos no início do estudo. Um total de 24,8% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 17,3% que foram positivos no início do estudo.
Em um estudo de 26 semanas com pacientes pediátricos com diabetes tipo 1, entre os 519 pacientes que receberam Fiasp®, 97,1% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 94,6% que resultaram positivos no início do estudo. Um total de 19,1% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 16,0% que foram positivos no início do estudo.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos -VIGIMED, disponível em http://portal.anvisa.gov.br/vigimed, ou para a Vigilância Sanitária Estadual ou Municipal.
10. SUPERDOSE
As reações adversas listadas nesta seção são consideradas esperadas com o uso deste medicamento. Uma superdose específica para insulina não pode ser definida, no entanto, a hipoglicemia pode se desenvolver ao longo de estágios sequenciais se um paciente receber mais insulina do que o necessário.
Os episódios hipoglicêmicos leves podem ser tratados por administração oral de glicose ou outros produtos contendo açúcar. Recomenda-se, portanto, que o paciente com diabetes sempre carregue produtos contendo glicose.
Episódios hipoglicêmicos graves, em que o paciente não pode se tratar, podem ser tratados com glucagon (0,5 a 1 mg), administrado por via intramuscular ou subcutânea por uma pessoa treinada, ou com glicose administrada por via intravenosa por um profissional de saúde. A glicose deve ser administrada por via intravenosa se o paciente não responder ao glucagon dentro de 10 a 15 minutos. Após recobrar a consciência, recomenda-se a administração de carboidratos orais ao paciente para prevenir uma recidiva.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Dizeres legais.
Registro MS 1.1766.0035
VENDA SOB PRESCRIÇÃO MÉDICA
Esta bula foi aprovada pela ANVISA em 30/09/2019.
FIASP
NOVO NORDISK
FlexTouch
insulina
Hipoglicemiante.
Apresentações.
Solução injetável de insulina asparte 100 U/mL, disponível em sistema de aplicação preenchido com 3 mL.
Cada embalagem contém 1 sistema de aplicação.
VIA SUBCUTÂNEA E INTRAVENOSA
USO ADULTO E PEDIÁTRICO ACIMA DE 1 ANO
Composição.
O princípio ativo é a insulina asparte. 1 mL da solução contém 100 Unidades (U) (equivalente a 3,5 mg) de insulina asparte. Um sistema de aplicação preenchido contém 300 U de insulina asparte em 3 mL de solução injetável.
Excipientes: fenol, metacresol, glicerol, acetato de zinco, fosfato de sódio dibásico di-hidratado, cloridrato de arginina, nicotinamida, ácido clorídrico, hidróxido de sódio e água para injetáveis. A insulina asparte é produzida por tecnologia do DNA recombinante em Saccharomyces cerevisiae.
Informações técnicas.
1. INDICAÇÕES
Fiasp® é indicado para melhorar o controle glicêmico em adultos e crianças maiores de 1 ano de idade com diabetes mellitus.
2. RESULTADOS DE EFICÁCIA
• População adulta
Fiasp® foi avaliado em 2068 pacientes adultos randomizados com diabetes mellitus tipo 1 (1143 pacientes) e diabetes mellitus tipo 2 (925 pacientes) em 3 estudos de eficácia e segurança de longo prazo (18 -26 semanas de tratamento).
Pacientes com diabetes mellitus tipo 1:
Fiasp® foi efetivo na obtenção do controle glicêmico quando administrado pré-prandial ou pós-prandial. A redução na HbA1c foi estatística e significativamente maior com Fiasp® administrado na hora da refeição em comparação com NovoRapid® (Figura 1, Tabela 1).
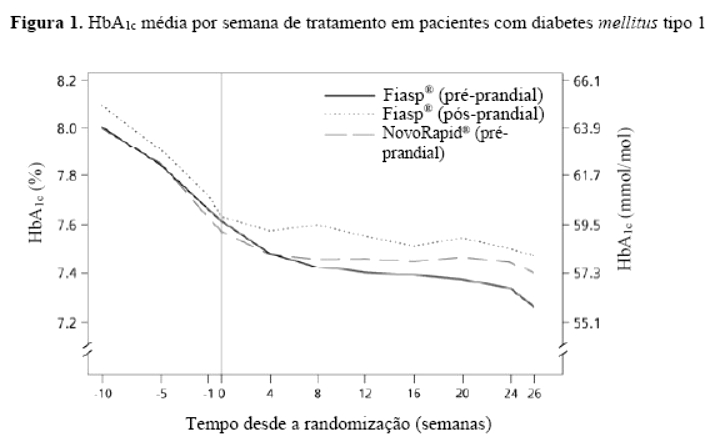
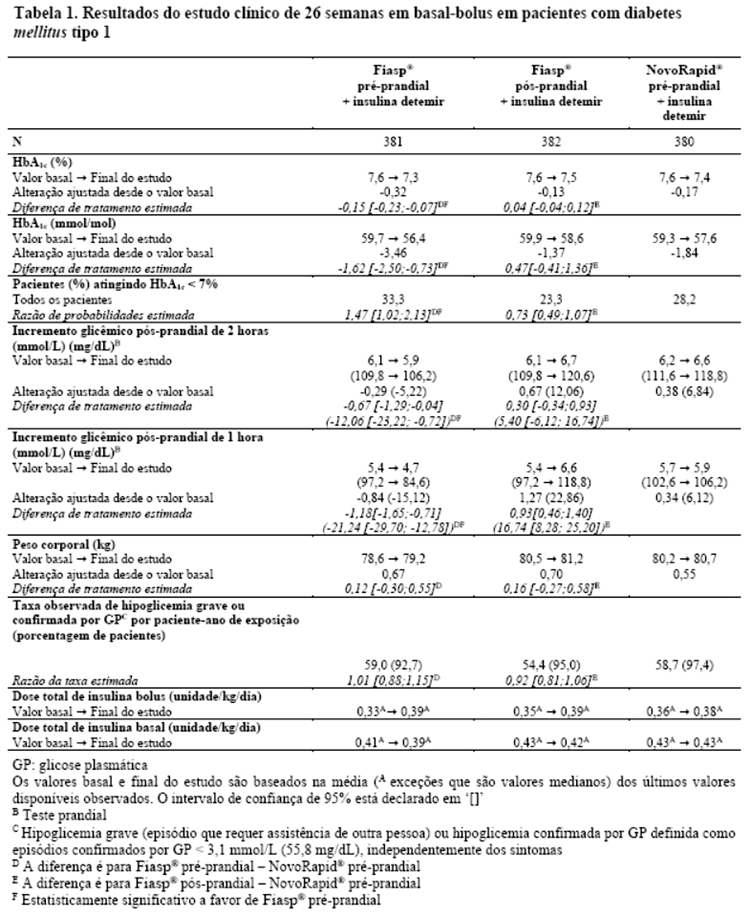
Em pacientes com diabetes mellitus tipo 1, Fiasp® proporcionou um maior controle glicêmico geral do que NovoRapid®. Fiasp® proporcionou um melhor controle glicêmico pós-prandial do que NovoRapid®, sem aumento no risco global de hipoglicemia grave ou confirmada em pacientes com diabetes mellitus tipo 1 ou tipo 2 (Tabela 1 e 2).
Pacientes com diabetes mellitus tipo 2:
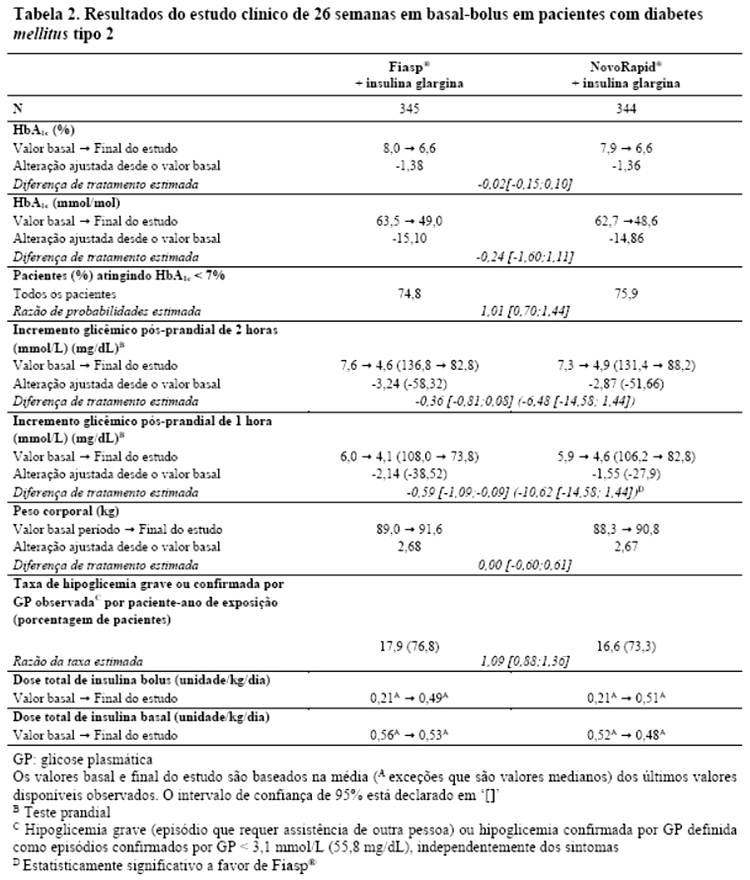
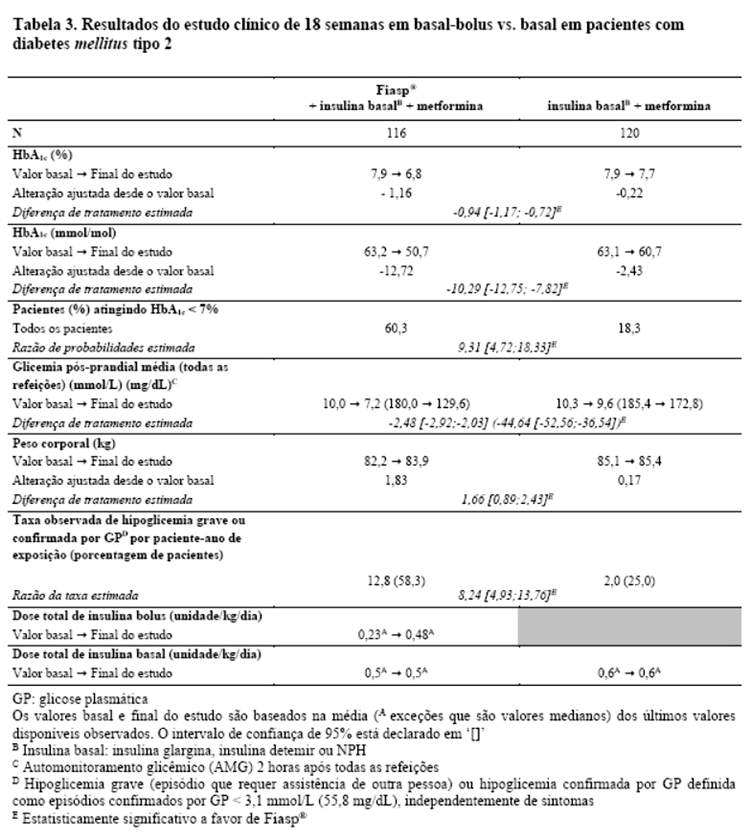
Fiasp® foi efetivo no controle glicêmico em pacientes com diabetes mellitus tipo 2 (Tabela 2). Fiasp® em combinação com insulina basal diária e metformina resultou em uma redução superior na HbA1c e uma redução estatisticamente significativa na glicemia pós-prandial em pacientes com diabetes mellitus tipo 2 em comparação à insulina basal diária com metformina (Tabela 3).
Idosos:
Nos três estudos clínicos controlados, 192 de 1219 (16%) pacientes com diabetes mellitus tipo 1 ou diabetes mellitus tipo 2 tratados com Fiasp® tinham ≥ 65 anos de idade e 24 de 1219 (2%) tinham ≥ 75 anos de idade. Nenhuma diferença geral na segurança ou eficácia foi observada entre pacientes idosos e mais jovens.
Infusão subcutânea contínua de insulina (CSII) (do inglês, Continuous Subcutaneous Insulin Infusion)
Um estudo de 6 semanas, randomizado (2:1), duplo-cego, de grupos paralelos com controle ativo avaliou a compatibilidade de Fiasp® e NovoRapid® administrados por meio do sistema CSII em pacientes adultos com diabetes mellitus tipo 1. Não houve episódios microscopicamente confirmados de oclusões no equipo de infusão nos grupos Fiasp® (n=25) ou NovoRapid® (n=12). Houve dois pacientes do grupo Fiasp® que relataram, cada um, duas reações no local de infusão decorrentes do tratamento.
• População pediátrica
A eficácia e segurança de Fiasp® foram avaliadas em um estudo clínico 1:1:1, randomizado, ativo-controlado, em crianças e adolescentes com diabetes mellitus tipo 1, entre 1 e 18 anos de idade, por um período de 26 semanas (n=777). Neste estudo, foram avaliadas a eficácia e segurança de Fiasp® administrado pré-prandial (0-2 minutos antes da refeição) ou pós-prandial (20 minutos após o início da refeição) e de NovoRapid® administrado pré-prandial, ambos em combinação com insulina degludeca. O desfecho primário foi a avaliação da alteração de HbA1c em relação ao valor basal 26 semanas após a randomização para todos os pacientes randomizados.
Este estudo clínico incluiu um período de triagem de 2 semanas, um período de "run-in" de 12 semanas (para otimização da insulina basal), um período de 26 semanas de tratamento e um período de 30 dias de acompanhamento. Durante o período de tratamento, a insulina em bolus foi titulada para o alvo glicêmico pré-prandial de 4,0-8,0 mmol/L (71-145 mg/dL) e alvo glicêmico na hora de dormir de 6,7-10,0 mmol/L (120-180 mg/dL), em uma abordagem de alvo de tratamento.
Os seguintes critérios de inclusão foram utilizados neste estudo clínico:
- Diagnóstico de DM1 (baseado em avaliação clínica e apoiado por análises laboratoriais de acordo com as diretrizes locais); - Tratamento diário em andamento com um regime de insulina basal-bolus com uma insulina análoga basal ou NPH por pelo menos 90 dias antes da visita de triagem;
- HbA1c ≤9.5% (80 mmol/mol) analisado pelo laboratório central na visita de triagem.
Os pacientes no braço de Fiasp® pré-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 144 adolescentes entre 12 e 17 anos de idade. Os pacientes no braço de Fiasp® pós-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 143 adolescentes entre 12 e 17 anos de idade.
Fiasp® administrado pré-prandial demonstrou superioridade quando comparado a NovoRapid® em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: -0,17% [-0,30; -0,03] IC95%). Fiasp® administrado pós-prandial demonstrou não inferioridade quando comparado a NovoRapid®, em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: 0.13% [-0.01; 0.26] IC95%).
Foi observada diferença estatisticamente significativa a favor de Fiasp® administrado pré-prandial, quando comparado a NovoRapid® pré-prandial após 26 semanas, em relação ao nível basal de glicemia pós-prandial, 1 hora após o almoço e jantar. Para Fiasp® pós-refeição, foi observada diferença estatisticamente significativa a favor de NovoRapid® pré-prandial em relação a este parâmetro.
Não foi observado aumento geral do risco de hipoglicemia grave ou confirmada em comparação a NovoRapid®.
Os efeitos observados e os perfis de segurança foram comparáveis entre todos os grupos etários.
Referências:
1. Russell-Jones D, et al. Fast-Acting Insulin Aspart Improves Glycemic Control in Basal-Bolus Treatment for Type 1 Diabetes: Results of a 26-Week Multicenter, Active-Controlled, Treat-to-Target, Randomized, Parallel-Group Trial (onset 1). Diabetes Care 2017;40:943-950.
2. Bowering K, et al. Faster Aspart Versus Insulin Aspart as Part of a Basal-Bolus Regimen in Inadequately Controlled Type 2 Diabetes: The onset 2 Trial. Diabetes Care 2017;40:951-957.
3. Rodbard HW, et al. Adding fast-acting insulin aspart to basal insulin significantly improved glycaemic control in patients with type 2 diabetes: A randomized, 18-week, open-label, phase 3 trial (onset 3). Diabetes Obes Metab 2017;19:1389-1396.
4. Zijlstra E, et al. Investigation of Pump Compatibility of Fast-Acting Insulin Aspart in Subjects With Type 1 Diabetes. J Diabetes Sci Technol 2018;12(1):145-151.
5. Bode BW, et al. Efficacy and Safety of Fast-Acting Insulin Aspart Compared With Insulin Aspart, Both in Combination With Insulin Degludec, in Children and Adolescents With Type 1 Diabetes: The onset 7 Trial. Diabetes Care 2019;42(7):1255-1262.
3. CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismo de ação
A atividade primária de Fiasp® é a regulação do metabolismo da glicose.
As insulinas, incluindo insulina asparte, princípio ativo de Fiasp® , exercem a sua ação específica por meio da ligação aos receptores da insulina. A insulina ligada ao receptor reduz a glicemia facilitando a captação celular de glicose no músculo esquelético e no tecido adiposo, e inibindo a saída de glicose do fígado.
A insulina inibe a lipólise no adipócito, inibe a proteólise e aumenta a síntese de proteína.
Dados Farmacodinâmicos
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início de ação mais rápido e maior efeito hipoglicemiante inicial em comparação com NovoRapid®. Isso deve ser considerado ao prescrever Fiasp®.
O início de ação foi 5 minutos mais rápido e o tempo para a taxa de infusão máxima de glicose foi 11 minutos mais curto com Fiasp® do que com NovoRapid®.
O efeito hipoglicêmico (AUCGIR) foi 74% maior durante os primeiros 30 minutos com Fiasp® do que com NovoRapid®. O efeito hipoglicemiante total e o efeito hipoglicemiante máximo (GIRmax) foram comparáveis entre Fiasp® e NovoRapid®. O efeito hipoglicemiante total e o efeito hipoglicemiante máximo de Fiasp® aumentam linearmente com o aumento da dose dentro da faixa de dose terapêutica.
A duração de ação foi mais curta e o efeito hipoglicemiante tardio foi 10% menor para Fiasp® comparado com aquele de NovoRapid®.
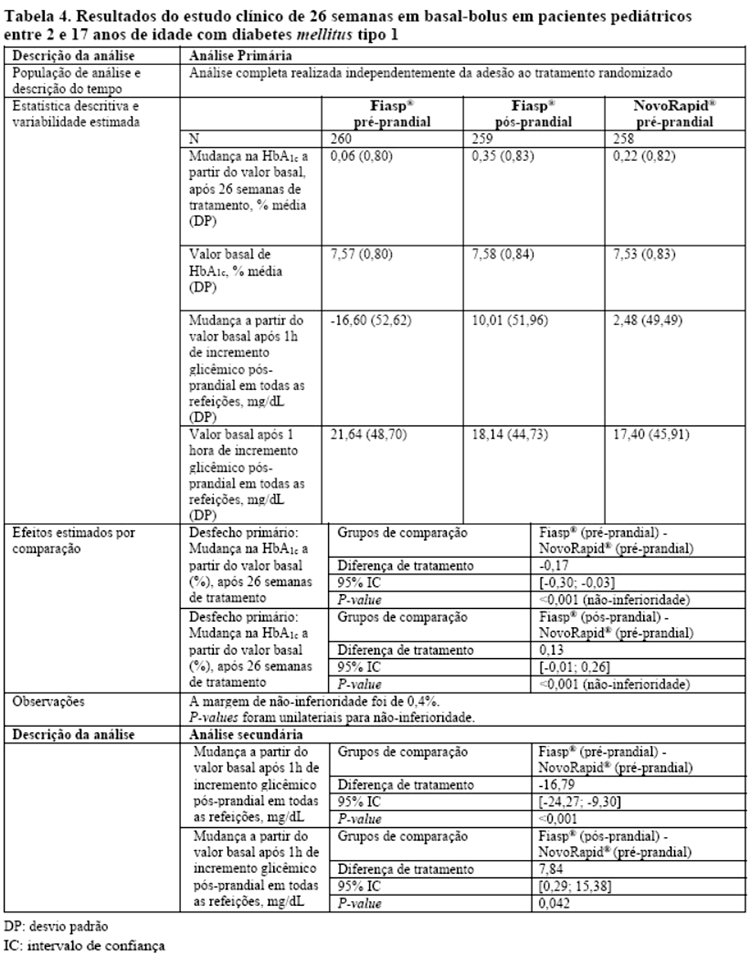
Fiasp® injetado pré-prandial produziu um efeito hipoglicemiante pós-prandial significativamente maior após um teste prandial padronizado em comparação com NovoRapid®. A diferença de tratamento na redução do incremento glicêmico pós-prandial de 2 horas foi estatisticamente significativa em favor de Fiasp® (-0,67 mmol/L [-1,29; -0,04] IC95%) (-12,06 mg/dL [-23,22; -0,72] IC95%). A diferença de tratamento na redução do incremento glicêmico pós-prandial de 1 hora foi de -1,18 mmol/L [-1,65; -0,71] IC95% (-21,24 mg/dL [-29,70; -12,78] IC95%), consistente com o perfil de absorção mais rápido (vide Tabela 1, na seção "2. Resultados de eficácia" e Figura 2).
A variabilidade diária intraindividual no efeito hipoglicemiante foi baixa para Fiasp® para o efeito hipoglicemiante inicial (AUCGIR, 0-1h, CV~26%), total (AUCGIR, 0-12h, CV~18%) e máximo (GIRmax, CV 19%).
Infusão subcutânea contínua de insulina (CSII)
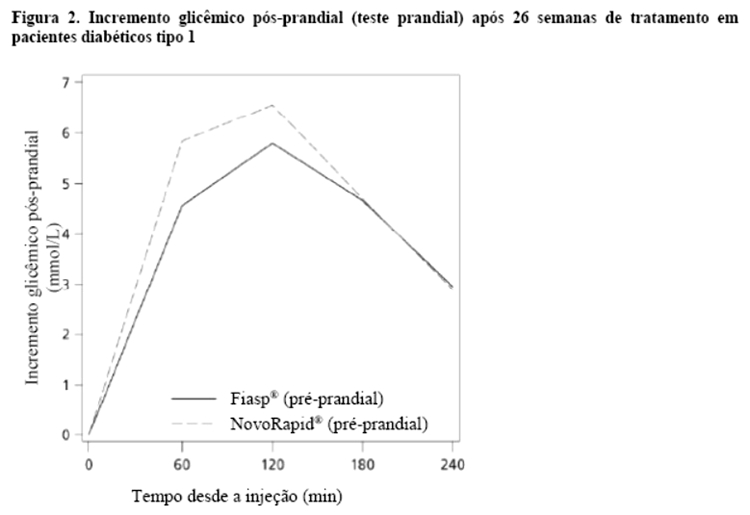
Fiasp® mostrou um efeito hipoglicemiante pós-prandial maior após um teste prandial padronizado com relação à resposta glicêmica pós-prandial (PPG, do inglês, Post-Prandial blood Glucose) de 1 hora e 2 horas (diferença de tratamento: -0,50 mmol/L [-1,07; 0,07] IC 95% (-9,00 mg/dL [-30,60; 1,26] IC95%) e -0,99 mmol/L [-1,95; -0,03] IC 95% (-17,82 mg/dL [-35,10; -0,54] IC95%), respectivamente em comparação com NovoRapid® (Figura 3) em um contexto de CSII.
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de ação mais rápido e um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo semelhante em comparação com NovoRapid®.
O efeito hipoglicemiante total e máximo com Fiasp® foi comparável entre idosos e mais jovens.
Obesidade:
O efeito do IMC na farmacodinâmica de Fiasp® foi explorado em uma análise transversal de estudos farmacodinâmicos. Fiasp® teve um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo comparável a NovoRapid® nos níveis de IMC em pacientes com diabetes mellitus tipo 1. Uma tendência para redução no efeito hipoglicemiante de Fiasp® com o aumento no IMC foi observada em pacientes com diabetes mellitus tipo 1.
Propriedades Farmacocinéticas
Absorção:
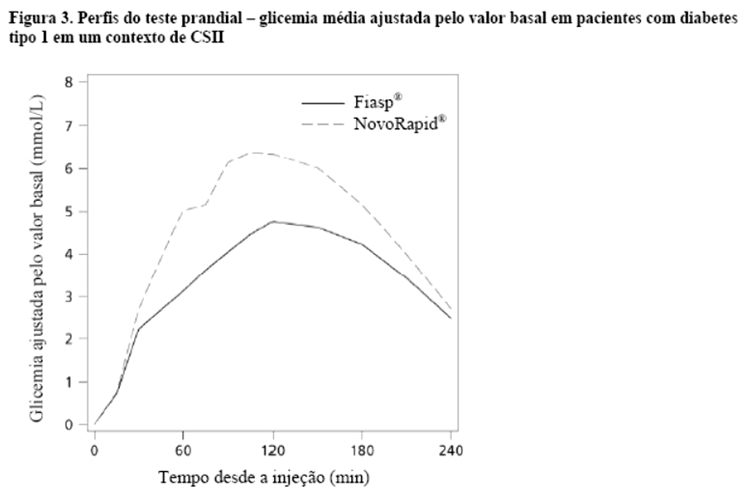
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início mais rápido de exposição e maior exposição inicial à insulina após a administração em bolus por meio da injeção subcutânea (Figura 4, Tabela 4) ou por meio de CSII em bombas (Figura 5) em comparação com NovoRapid®.
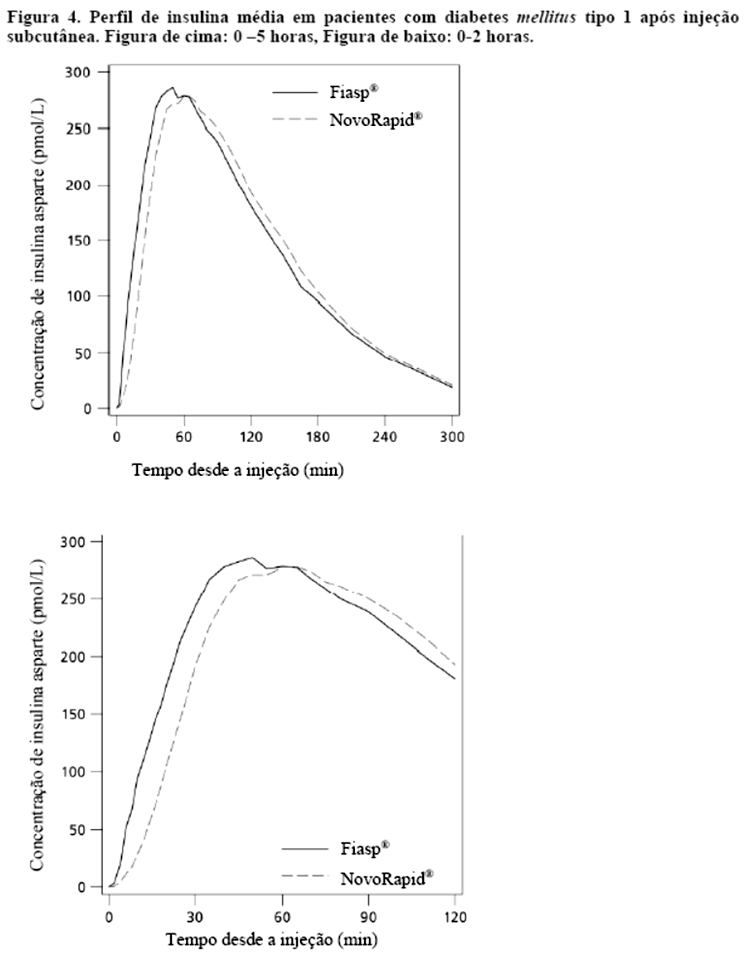
Após administração de Fiasp®, a insulina apareceu na circulação aproximadamente 4 minutos após a administração. O início do aparecimento foi duas vezes mais rápido (correspondendo a 5 minutos mais cedo), o tempo até 50% da concentração máxima foi 9 minutos mais curto com Fiasp® comparado a NovoRapid® com o dobro da insulina disponível durante os primeiros 30 minutos (Tabela 5). A exposição total à insulina (AUCinsulina asparte, 0-12horas) e a concentração máxima de insulina (Cmax) foram comparáveis entre Fiasp® e NovoRapid®. A exposição total e a concentração máxima de insulina aumentam de maneira proporcional com o aumento da dose subcutânea de Fiasp® dentro da faixa de dose terapêutica.

Infusão subcutânea contínua de insulina (CSII):
O início da exposição em um contexto de CSII (tempo até atingir a concentração máxima) foi 26 minutos mais curto com Fiasp® em comparação a NovoRapid®, resultando em aproximadamente três vezes mais insulina disponível durante os primeiros 30 minutos (Figura 5). A duração da exposição (tempo de atraso 50% Cmax) foi 35 minutos mais curta com Fiasp® comparado a NovoRapid®.
Distribuição:
A insulina asparte possui uma baixa afinidade de ligação a proteínas plasmáticas ( < 10%), semelhante àquela observada com a insulina humana regular.
Biotransformação:
A degradação de insulina asparte é semelhante àquela da insulina humana.
Eliminação:
A meia-vida após a administração subcutânea de Fiasp® é de 57 minutos e comparável à de NovoRapid®.
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de exposição mais rápido e uma exposição à insulina inicial maior, mantendo uma exposição total e uma concentração máxima semelhantes, comparada com NovoRapid®.
O efeito da idade na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Não foi observada relação entre exposição total à insulina de Fiasp® e idade (faixa etária entre 18-83 anos).
Sexo:
O efeito do sexo na farmacocinética de Fiasp® foi avaliado cruzando-se os dados de todos os estudos de farmacocinética. Fiasp® mostrou um início de exposição mais rápido comparável e uma exposição à insulina inicial mais alta, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid® para pacientes do sexo feminino e masculino com diabetes mellitus tipo 1.
A exposição inicial e máxima à insulina de Fiasp® foi comparável entre pacientes do sexo feminino e masculino com diabetes mellitus tipo 1. No entanto, a exposição total à insulina foi maior em pacientes do sexo feminino em comparação à do sexo masculino com diabetes mellitus tipo 1.
Obesidade:
O efeito do IMC na farmacocinética de Fiasp® foi explorado em uma análise cruzada de estudos farmacocinéticos. Para pacientes com diabetes mellitus tipo 1, a maior exposição inicial à insulina para Fiasp® comparada a NovoRapid® foi conservada nos níveis de IMC e esta diferença de tratamento aumentou com o aumento do IMC. A exposição total e máxima à insulina foi comparável entre Fiasp® e NovoRapid® nos níveis de IMC.
O efeito do IMC na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Nenhuma relação entre exposição total à insulina de Fiasp® e IMC foi observada.
Raça e Etnia:
O efeito da raça e etnia (negros versus brancos e hispânicos versus não hispânicos) na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Para Fiasp®, nenhuma diferença em exposição foi encontrada entre os grupos raciais e étnicos investigados.
Insuficiência hepática:
Um estudo de farmacocinética de dose única de insulina asparte foi realizado em 24 indivíduos com função hepática variando de normal a gravemente comprometida. Em participantes do estudo com comprometimento hepático, a taxa de absorção foi reduzida e mais variável.
Insuficiência renal:
O efeito do comprometimento renal na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. A função renal foi definida usando clearance de creatinina (CLcr) como segue: ≥90 mL/min (normal)(N=546), 60-89 mL/min (leve)(N=115), 30-59 mL/min (moderado)(N=21). A exposição total mais alta foi observada com decréscimo na função renal para Fiasp®. No entanto, houve alguma variabilidade entre participantes do estudo na exposição total nos pacientes com diabetes mellitus tipo 1 com comprometimento renal leve ou moderado. Portanto, como com todas as insulinas, o monitoramento glicêmico deve ser intensificado e a dose de Fiasp® ajustada individualmente em pacientes com insuficiência renal.
População pediátrica:
Em crianças (6-11 anos) e adolescentes (12-18 anos), Fiasp® mostrou um início mais rápido de exposição e uma exposição inicial mais alta à insulina, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid®.
O início de ação e a exposição inicial a Fiasp® foram similares entre crianças, adolescentes e adultos. A exposição total a Fiasp® foi menor em crianças e adolescentes em comparação com adultos quando administradas 0,2 unidades/kg de peso corporal, enquanto a concentração plasmática máxima de insulina asparte foi similar entre todos os grupos etários.
Dados de segurança pré-clínico
Dados não clínicos não revelaram risco especial para seres humanos com base nos estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade e toxicidade de reprodução após a exposição à insulina asparte.
Em testes in vitro, incluindo ligação à insulina, sítios de receptor de IGF-1 e efeitos no crescimento celular, a insulina asparte se comportou de uma maneira semelhante à insulina humana. Estudos também demonstram que a dissociação da ligação da insulina asparte ao receptor de insulina é equivalente a da insulina humana.
4. CONTRAINDICAÇÕES
- Hipersensibilidade a substância ativa ou a qualquer um dos excipientes (vide seção "Composição")
- Pacientes apresentando sintomas de hipoglicemia (vide seção "9. Reações Adversas").
5. ADVERTÊNCIAS E PRECAUÇÕES
Antes de viajar entre zonas de fuso horário diferente, o paciente deve procurar orientação médica, já que isso pode significar que o paciente deve usar a insulina e fazer as refeições em períodos diferentes.
Hipoglicemia:
A omissão de uma refeição ou exercício físico não planejado e extenuante pode levar à hipoglicemia.
A hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina (vide seção "9. Reações Adversas" e "10. Superdose").
Os pacientes cujo controle glicêmico é amplamente melhorado, por exemplo, pela insulinoterapia intensificada, podem apresentar uma alteração nos seus sintomas habituais de alerta da hipoglicemia, e devem ser aconselhados de acordo. Os sintomas habituais de alerta podem desaparecer em pacientes com diabetes mellitus de longa data.
O momento da hipoglicemia geralmente reflete o perfil de tempo-ação da formulação da insulina administrada. Fiasp® possui um perfil de tempo de ação distinto (vide seção "Mecanismo de ação") o que impacta o momento da hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que se ocorrer a hipoglicemia, ela pode ocorrer mais cedo após uma injeção/infusão quando comparado com outras insulinas prandiais.
Como Fiasp® deve ser administrado no início de uma refeição ou no pós-prandial (dentro de 20 minutos após iniciar uma refeição), o rápido início de ação deve, portanto, ser considerado em pacientes com esvaziamento gástrico atrasado.
Este medicamento não deve ser usado enquanto o paciente apresentar sintomas de hipoglicemia.
População pediátrica
O monitoramento rigoroso da glicemia é recomendado se este medicamento for administrado após o início da última refeição do dia, para evitar hipoglicemia noturna.
Hiperglicemia:
O uso de doses inadequadas ou a descontinuação do tratamento, especialmente em pacientes que necessitam de insulina, pode levar à hiperglicemia e à cetoacidose diabética, condições que são potencialmente letais.
Infusão subcutânea contínua de insulina (CSII):
Defeitos na bomba ou no equipamento de infusão podem levar a um início rápido de hiperglicemia e cetose. A identificação imediata e a correção da causa da hiperglicemia ou cetose são necessárias. Terapia interina com injeção subcutânea pode ser necessária.
Doenças concomitantes:
Doenças concomitantes renais, hepáticas ou que afetam as glândulas suprarrenais, hipófise ou tireoide podem exigir modificações na dose de insulina.
Transferência de outras insulinas:
Vide seção "8. Posologia e modo de usar".
Em combinação com tiazolidinedionas e insulinas:
Casos de insuficiência cardíaca congestiva foram relatados quando as tiazolidinedionas foram usadas em combinação com insulina, especialmente em pacientes com fatores de risco para o desenvolvimento de insuficiência cardíaca congestiva. Isto deve ser considerado se o tratamento com a combinação de tiazolidinedionas e insulina for considerado. Se a combinação for usada, os pacientes devem ser observados para sinais e sintomas de insuficiência cardíaca congestiva, ganho de peso e edema. Tiazolidinedionas devem ser descontinuadas se ocorrer qualquer deterioração nos sintomas cardíacos.
Iniciação da insulina e intensificação do controle glicêmico:
A intensificação ou melhora rápida no controle glicêmico foi associada a um transtorno transitório e reversível de refração oftalmológica, piora da retinopatia diabética, neuropatia periférica aguda dolorosa e edema periférico. No entanto, o controle glicêmico de longo prazo reduz o risco de retinopatia e neuropatia diabética.
Anticorpos contra insulina:
A administração de insulina pode causar a formação de anticorpos contra insulina. Em casos raros, a presença de tais anticorpos contra insulina pode ocasionar a necesssidade de ajuste da dose de insulina para corrigir uma tendência para hiper ou hipoglicemia.
Prevenção de misturas acidentais / erros de medicação:
Os pacientes devem ser instruídos a verificar sempre o rótulo da insulina antes de cada injeção, para evitar misturas acidentais entre Fiasp® e outras insulinas.
Os pacientes devem verificar visualmente as unidades da dose antes da administração de Fiasp®. Portanto, o requisito para a autoadministração por pacientes é que eles possam ler a escala de dose. Os pacientes que são cegos ou têm pouca visão devem ser instruídos a sempre obter assistência de outra pessoa que tenha boa visão e esteja treinada na administração de insulinas.
Efeitos na capacidade de dirigir e operar máquinas:
A capacidade do paciente de se concentrar e reagir pode ser prejudicada como resultado da hipoglicemia. Isto pode constituir um risco em situações em que essas habilidades sejam de importância especial (por exemplo, dirigir um carro ou operar máquinas).
Os pacientes devem ser aconselhados a tomar precauções para evitar a hipoglicemia ao dirigir. Isto é particularmente importante para aqueles que têm pouco ou nenhum conhecimento dos sinais de alerta para hipoglicemia ou que têm episódios frequentes de hipoglicemia. A conveniência de dirigir deve ser considerada nessas circunstâncias.
Informações referentes à fertilidade, gravidez e amamentação
Fertilidade:
Estudos de reprodução em animais não revelaram diferenças entre a insulina asparte e a insulina humana em relação à fertilidade.
Gravidez:
Não há dados disponíveis com o uso de Fiasp® em mulheres grávidas para informar um risco associado ao medicamento para defeitos congênitos maiores e aborto. Informações disponíveis de estudos randomizados-controlados com o uso de insulina asparte durante o segundo trimestre de gravidez não demonstraram uma associação entre a insulina asparte e defeitos congênitos maiores, desfechos adversos materno ou desfechos adversos fetais. Existem riscos para a mãe e o feto associados ao diabetes mal controlado na gravidez.
O controle glicêmico intensificado e o monitoramento de mulheres grávidas com diabetes mellitus (diabetes mellitus tipo 1, diabetes mellitus tipo 2 ou diabetes mellitus gestacional) são recomendados durante toda a gravidez e quando pretende-se engravidar. As necessidades de insulina geralmente diminuem no primeiro trimestre e aumentam subsequentemente durante o segundo e terceiro trimestre. Após o parto, normalmente as necessidades de insulina retornam rapidamente aos valores pré-gestacionais.
Categoria de risco na gravidez: A
Este medicamento pode ser utilizado durante a gravidez desde que sob prescrição médica ou do cirurgião-dentista.
Amamentação:
Não existem restrições no tratamento com Fiasp® durante a amamentação. O tratamento da mãe lactante com insulina não apresenta risco ao bebê. No entanto, a dose de Fiasp® pode precisar ser ajustada.
Este medicamento pode causar doping.
6. INTERAÇÕES MEDICAMENTOSAS
Alguns medicamentos são conhecidos por interagir com o metabolismo da glicose.
As substâncias a seguir podem reduzir a necessidade de insulina:
Medicamentos antidiabéticos orais, inibidores da monoaminoxidase (IMAO), betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), salicilatos, esteroides anabolizantes, sulfonamidas e agonista do receptor de GLP-1.
As substâncias a seguir podem aumentar a necessidade de insulina:
Contraceptivos orais, tiazidas, glicocorticoides, hormônios tireoidianos, simpatomiméticos, hormônio do crescimento e danazol.
Os agentes betabloqueadores podem mascarar os sintomas da hipoglicemia.
A octreotida/lanreotida podem aumentar ou diminuir as necessidades de insulina.
O álcool pode intensificar ou reduzir o efeito hipoglicêmico da insulina.
7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Antes do primeiro uso:
Armazenar sob refrigeração (entre 2°C e 8°C). Mantenha distante do compartimento do congelador. Não congelar. Mantenha o sistema de aplicação tampado para protegê-lo da luz. Este medicamento tem prazo de validade de 30 meses.
Após o primeiro uso ou carregado como reserva:
Válido por 4 semanas, quando armazenado em temperaturas de até 30°C ou sob refrigeração (entre 2°C e 8°C). Não congelar. Mantenha o sistema de aplicação tampado para protegê-lo da luz.
Não armazene o produto sob temperaturas acima de 30°C.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Número de lote e datas de fabricação e validade: vide embalagem.
A data de validade se refere ao último dia do mês indicado.
Fiasp® é uma solução aquosa injetável límpida e incolor.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
8. POSOLOGIA E MODO DE USAR
Método de administração:
Fiasp® FlexTouch® está disponível em um sistema de aplicação preenchido. Fiasp® FlexTouch® pode ser administrado com agulhas de até 8mm de comprimento. O sistema de aplicação foi desenvolvido para ser utilizado com agulhas descartáveis NovoFine®. Fiasp® FlexTouch® administra de 1-80 unidades em incrementos de 1 unidade. Fiasp® FlexTouch® é identificado por cores e vem acompanhado de uma bula contendo instruções detalhadas de uso que devem ser seguidas.
Injeção subcutânea:
Fiasp® é administrado pela via subcutânea na parede abdominal, na parte superior do braço ou na coxa. Os locais de injeção devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia.
A duração da ação de Fiasp® pode variar de acordo com a dose, local da injeção, fluxo sanguíneo, temperatura e nível de atividade física.
Infusão subcutânea contínua de insulina (CSII):
Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas adequadas para infusão de insulina. Fiasp® pode ser administrado de acordo com as instruções fornecidas pelo fabricante da bomba, de preferência no abdômen. Os locais de infusão devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia. Quando usado com uma bomba de infusão de insulina, Fiasp® não deve ser diluído ou misturado com outras insulinas.
Os pacientes que usam CSII devem ser orientados sobre o uso da bomba com o reservatório e tubo corretos. O equipo de infusão (tubo e cânula) deve ser trocado de acordo com as instruções do produto fornecidas com o equipo de infusão.
Pacientes que administram Fiasp® por CSII devem ser treinados para administrar insulina por injeção e ter a insulinoterapia alternativa disponível em caso de falha da bomba.
Uso intravenoso:
Se necessário, Fiasp® pode ser administrado pela via intravenosa por profissionais de saúde.
Para uso intravenoso, Fiasp® deve ser usado em concentrações de 0,5 unidade/mL a 1,0 unidade/mL de insulina asparte em sistemas de infusão usando bolsas de infusão de polipropileno. Fiasp® demonstrou ser estável em temperatura ambiente por 24 horas nos líquidos de infusão, como cloreto de sódio 0,9% ou dextrose 5%. O monitoramento da glicemia é necessário durante a infusão de insulina. Deve-se tomar cuidado para assegurar que a insulina seja injetada na bolsa de infusão e não simplesmente no acesso de entrada da bomba.
Não há dados de segurança e eficácia da utilização intravenosa de Fiasp® em crianças.
Precauções especiais para manuseio e descarte:
As agulhas e Fiasp® FlexTouch® não devem ser compartilhados. O carpule não deve ser preenchido.
Fiasp® não deve ser usado se a solução não estiver límpida e incolor.
Fiasp® não deve ser usado se foi congelado.
O paciente deve descartar a agulha após cada aplicação.
Qualquer resíduo deve ser descartado de acordo com as exigências locais.
Para casos de emergência (hospitalização ou mal funcionamento do sistema de aplicação) em pacientes que utilizam Fiasp®, o medicamento pode ser extraído do sistema de aplicação com a ajuda de uma seringa de 100 U de insulina.
Incompatibilidades:
Substâncias adicionadas a Fiasp® podem causar a degradação da insulina asparte.
Fiasp® não deve ser diluído ou misturado com outros medicamentos, exceto em casos de fluídos para infusão, conforme descrito no item "Método de administração".
Posologia:
Fiasp® é uma insulina para administração subcutânea pré-prandial ou pós-prandial (em até 20 minutos após iniciar uma refeição). Além disso, Fiasp® pode ser usado em infusão subcutânea contínua de insulina (CSII) em bombas de infusão ou ser administrado por via intravenosa por profissionais de saúde.
A potência dos análogos da insulina, incluindo Fiasp®, é expressa em unidades. Uma (1) unidade de Fiasp® corresponde a 1 unidade internacional de insulina humana ou 1 unidade de outros análogos da insulina de ação rápida.
A posologia de Fiasp® é individual e determinada de acordo com as necessidades do paciente.
- Terapia por injeção: Fiasp® deve ser usada em combinação com insulina de ação intermediária ou longa administrada pelo menos uma ve
z ao dia. Em um regime de tratamento basal-bolus, aproximadamente 50% desta necessidade pode ser fornecida por Fiasp® e o restante pela insulina de ação intermediária ou longa.
- CSII: Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas. Neste caso, Fiasp® cobrirá a necessidade da insulina bolus (aproximadamente 50%) e da insulina basal.
O monitoramento da glicemia e o ajuste na dose de insulina são recomendados para atingir o controle glicêmico ideal.
A necessidade individual de insulina diária total em adultos, adolescentes e crianças pode variar e é geralmente entre 0,5 e 1,0 unidade/kg/dia.
O ajuste da dose pode ser necessário se os pacientes aumentarem a atividade física, modificarem a sua dieta habitual ou durante doença concomitante. Os níveis glicêmicos devem ser monitorados de modo adequado sob essas condições.
O início de ação mais rápido deve ser considerado ao prescrever Fiasp® (vide seção "3. Características farmacológicas").
Iniciação
Pacientes com diabetes mellitus tipo 1:
A dose inicial recomendada de Fiasp® em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina é de aproximadamente 50% da dose total de insulina diária e deve ser dividida entre cada refeição diária. O restante da dose total de insulina diária deve ser administrado como insulina de ação intermediária ou longa. Como regra geral, 0,2 a 0,4 unidades de insulina por quilograma de peso corporal podem ser usadas para calcular a dose inicial de insulina diária total em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina.
Pacientes com diabetes mellitus tipo 2:
A dose inicial sugerida é de 4 unidades em uma ou mais refeições. O número de injeções e a titulação subsequente dependerão do alvo glicêmico individual.
Transferência de outra insulina
Recomenda-se o monitoramento glicêmico rigoroso durante a transferência de outras insulinas para uso na hora da refeição e nas semanas iniciais seguintes.
A conversão de outra insulina para uso na hora da refeição pode ser feita unidade por unidade. Devido ao início mais rápido de ação da insulina, Fiasp® deve ser injetado no início de uma refeição ou depois (em até 20 minutos após o início de uma refeição).
A transferência de um paciente de outro tipo, marca ou fabricante de insulina para Fiasp® deve ser feita sob supervisão médica e pode resultar na necessidade para uma modificação na dose.
Doses e horários das insulinas de ação intermediária ou longa concomitantes ou outro tratamento antidiabético concomitante podem precisar ser ajustados.
Pacientes com diabetes mellitus tipo 2
O ajuste de Fiasp® pode ser considerado diariamente com base no AMG (Automonitoramento Glicêmico) na hora da refeição e na hora de dormir do dia anterior de acordo com a Tabela 5.
• O Fiasp® pré-desjejum deve ser ajustado de acordo com o AMG pré-almoço do dia anterior.
• O Fiasp® pré-almoço deve ser ajustado de acordo com o AMG pré-jantar do dia anterior.
• O Fiasp® pré-jantar deve ser ajustado de acordo com o AMG na hora de dormir no dia anterior.
Idosos (≥ 65 anos de idade)
A segurança e eficácia de Fiasp® foram estabelecidas em pacientes idosos. Recomenda-se o monitoramento rigoroso da glicemia, e a dose de insulina deve ser ajustada individualmente (vide seção "3. Características Farmacológicas" e seção "2. Resultados de Eficácia").
Insuficiência renal e hepática
A insuficiência renal ou hepática pode reduzir as necessidades de insulina do paciente. Em pacientes com insuficiência renal ou hepática, o monitoramento glicêmico deve ser intensificado e a dose ajustada individualmente (vide seção "3. Características Farmacológicas").
População pediátrica
Fiasp® pode ser usado por adolescentes e crianças a partir de 1 ano de idade (vide seção "2. Resultados de eficácia"), substituindo a insulina humana regular quando um início de ação rápido for necessário, por exemplo, nos horários de aplicação da insulina prandial (vide seção "3. Características farmacológicas", itens "Propriedade farmacodinâmicas" e "Propriedades farmacocinèticas"). Fiasp® não foi avaliado para uso em crianças abaixo de 1 ano de idade e em crianças com diabetes mellitus tipo 2.
Não há experiência clínica com o uso de Fiasp® em crianças menores de 2 anos de idade.
Recomenda-se que Fiasp® seja administrado antes da refeição (0-2 minutos), com a flexibilidade de administrar em até 20 minutos após o início da refeição, quando existe incerteza sobre o consumo alimentar.
Dose esquecida
Pacientes em tratamento basal-bolus que esqueceram uma dose na hora da refeição devem ser aconselhados a monitorar o seu nível glicêmico para decidir se uma dose de insulina é necessária. Os pacientes devem retomar o seu esquema habitual de dose na próxima refeição.

9. REAÇÕES ADVERSAS
As reações adversas listadas nesta seção são consideradas esperadas para este medicamento.
Resumo do perfil de segurança
A reação adversa relatada com mais frequência durante o tratamento foi a hipoglicemia (vide item "Descrição das reações adversas selecionadas").
Reações adversas de estudos clínicos
As reações adversas listadas a seguir são baseadas em dados de seis estudos confirmatórios terapêuticos em adultos. Fiasp® foi comparado a NovoRapid® em cinco destes estudos, e comparado com insulina basal somente em um estudo. Nos seis estudos, 2163 pacientes foram tratados com Fiasp®; 1707 com diabetes mellitus tipo 1, dos quais 261 usando CSII, e 456 com diabetes mellitus tipo 2 (vide seção "2. Resultados de eficácia" para mais detalhes sobre os estudos). As reações adversas são classificadas de acordo com a Classe de Sistemas de Órgãos MedDRA. As categorias de frequência são definidas de acordo com a seguinte convenção: Muito comum (≥ 1/10); comum (≥ 1/100 a < 1/10); incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10,000 a < 1/1,000); muito rara ( < 1/10,000) e frequência desconhecida (não pode ser estimada com os dados disponíveis).
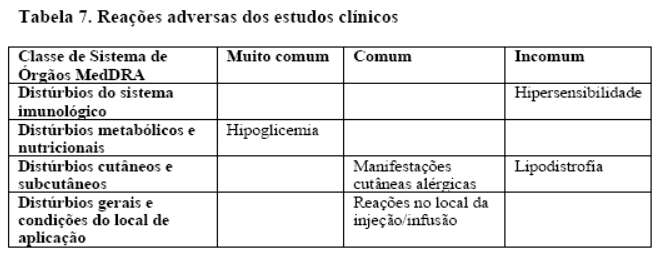
Descrição das reações adversas selecionadas
Reações alérgicas
Manifestações cutâneas alérgicas relatadas com Fiasp® (1,8% vs. 1,5% para comparador) incluem eczema, erupção cutânea, erupção cutânea prurítica, urticária e dermatite.
Com Fiasp®, reações de hipersensibilidade generalizada (manifestadas por erupção cutânea generalizada e edema facial) foram relatadas como incomum (0,2% vs. 0,3% para comparador). Com base nos dados obtidos após comercialização, formas graves de reações alérgicas sistêmicas podem ocorrer. Reações alérgicas do tipo imediato à insulina em si ou aos excipientes podem potencialmente ser de risco à vida.
Hipoglicemia
Hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina. Hipoglicemia grave pode levar à inconsciência e/ou convulsões e pode resultar em comprometimento temporário ou permanente da função cerebral ou até mesmo morte. Os sintomas de hipoglicemia geralmente ocorrem repentinamente. Eles podem incluir suores frios, pele pálida fria, fadiga, nervosismo ou tremor, ansiedade, cansaço ou fraqueza incomum, confusão, dificuldade de concentração, sonolência, fome excessiva, alterações de visão, cefaleia, náusea e palpitação. O tempo de hipoglicemia geralmente reflete o perfil tempo-ação da formulação de insulina administrada. Fiasp® possui um perfil de ação diferenciado (vide seção "Propriedades Farmacocinéticas/Propriedades Farmacodinâmicas"), que afeta o tempo de hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que, se houver hipoglicemia, pode ocorrer mais cedo após uma injeção/infusão de Fiasp® em comparação com outras insulinas prandiais.
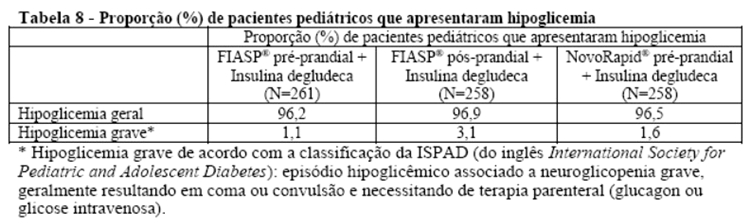
Lipodistrofia
Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) foi relatada no local da injeção/infusão em pacientes tratados com Fiasp® (0,5% vs. 0,2% no comparador). A rotação contínua do local da injeção dentro de uma mesma região em particular pode ajudar a reduzir o risco de desenvolver essas reações.
Reações no local da aplicação
Reações no local da injeção (incluindo erupção cutânea, rubor, inflamação, dor e hematoma) foram relatadas em pacientes tratados com Fiasp® (1,3% vs. 1,0% no comparador). Reações no local da infusão (incluindo rubor, inflamação, irritação, dor, hematoma e coceira) foram relatadas em pacientes tratados com Fiasp® (10,0% vs 8,3% no comparador). Essas reações são geralmente leves e transitórias e normalmente desaparecem durante o tratamento continuado.
População pediátrica
A eficácia e segurança foram investigadas em um estudo terapêutico confirmatório com crianças de 2 a 18 anos de idade, com diabetes mellitus tipo 1. No estudo, 519 pacientes foram tratados com Fiasp®. No geral, a frequência, o tipo e a gravidade das reações adversas na população pediátrica não indicaram diferenças quanto à experiência na população adulta. Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) no local da injeção foi relatada mais frequentemente no estudo com pacientes pediátricos em comparação com os estudos com adultos (veja acima). Na população pediátrica, lipodistrofia foi relatado com frequência de 2,1% para pacientes em uso de Fiasp® versus 1,6% para pacientes em uso de NovoRapid®.
Outras populações especiais
Com base nos resultados de estudos clínicos, a frequência, tipo e gravidade das reações adversas observadas em pacientes idosos e em pacientes com comprometimento renal ou hepático não indicam diferenças na experiência mais ampla na população geral. Fiasp® foi administrado a pacientes idosos para investigação das propriedades farmacocinéticas (vide seção "3. Características Farmacológicas").
Imunogenicidade
Como para todas as terapias derivadas de proteínas, existe um potencial de imunogenicidade. A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do teste e pode ser influenciada por diversos fatores, como: metodologia do teste, manuseio da amostra, tempo de coleta da amostra, medicação concomitante e doença pré-existente. Por estes motivos, a comparação da incidência de anticorpos contra Fiasp® nos estudos descritos abaixo com a incidência de anticorpos em outros estudos ou contra outros produtos pode ser enganosa.
Em um estudo de 26 semanas com pacientes adultos com diabetes tipo 1, entre os 763 pacientes que receberam Fiasp®, 97,2% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 90,3% que resultaram positivos no início do estudo. Um total de 24,8% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 17,3% que foram positivos no início do estudo.
Em um estudo de 26 semanas com pacientes pediátricos com diabetes tipo 1, entre os 519 pacientes que receberam Fiasp®, 97,1% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 94,6% que resultaram positivos no início do estudo. Um total de 19,1% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 16,0% que foram positivos no início do estudo.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos -VIGIMED, disponível em http://portal.anvisa.gov.br/vigimed, ou para a Vigilância Sanitária Estadual ou Municipal.
10. SUPERDOSE
As reações adversas listadas nesta seção são consideradas esperadas com o uso deste medicamento. Uma superdose específica para insulina não pode ser definida, no entanto, a hipoglicemia pode se desenvolver ao longo de estágios sequenciais se um paciente receber mais insulina do que o necessário:
Os episódios hipoglicêmicos leves podem ser tratados por administração oral de glicose ou outros produtos contendo açúcar. Recomenda-se, portanto, que o paciente com diabetes sempre carregue produtos contendo glicose.
Episódios hipoglicêmicos graves, em que o paciente não pode se tratar, podem ser tratados com glucagon (0,5 a 1 mg), administrado por via intramuscular ou subcutânea por uma pessoa treinada, ou com glicose administrada por via intravenosa por um profissional de saúde. A glicose deve ser administrada por via intravenosa se o paciente não responder ao glucagon dentro de 10 a 15 minutos. Após recobrar a consciência, recomenda-se a administração de carboidratos orais ao paciente para prevenir uma recidiva.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Dizeres legais.
Registro MS 1.1766.0035
VENDA SOB PRESCRIÇÃO MÉDICA
Esta bula foi aprovada pela ANVISA em 30/09/2019.
FIASP
NOVO NORDISK
Penfill
insulina
Hipoglicemiante.
Apresentações.
Solução injetável de insulina asparte 100 U/mL, disponível em carpule com 3 mL cada. Cada embalagem contém 5 carpules.
VIA SUBCUTÂNEA E INTRAVENOSA
USO ADULTO E PEDIÁTRICO ACIMA DE 1 ANO
Composição.
O princípio ativo é a insulina asparte. 1 mL da solução contém 100 Unidades (U) (equivalente a 3,5 mg) de insulina asparte. Cada carpule contém 300 U de insulina asparte em 3 mL de solução injetável.
Excipientes: fenol, metacresol, glicerol, acetato de zinco, fosfato de sódio dibásico di-hidratado, cloridrato de arginina, nicotinamida, ácido clorídrico, hidróxido de sódio e água para injetáveis. A insulina asparte é produzida por tecnologia do DNA recombinante em Saccharomyces cerevisiae.
Informações técnicas.
1. INDICAÇÕES
Fiasp® é indicado para melhorar o controle glicêmico em adultos e crianças maiores de 1 ano de idade com diabetes mellitus.
2. RESULTADOS DE EFICÁCIA
• População adulta
Fiasp® foi avaliado em 2068 pacientes adultos randomizados com diabetes mellitus tipo 1 (1143 pacientes) e diabetes mellitus tipo 2 (925 pacientes) em 3 estudos de eficácia e segurança de longo prazo (18 -26 semanas de tratamento).
Pacientes com diabetes mellitus tipo 1:
Fiasp® foi efetivo na obtenção do controle glicêmico quando administrado pré-prandial ou pósprandial. A redução na HbA1c foi estatística e significativamente maior com Fiasp® administrado na hora da refeição em comparação com NovoRapid® (Figura 1, Tabela 1).
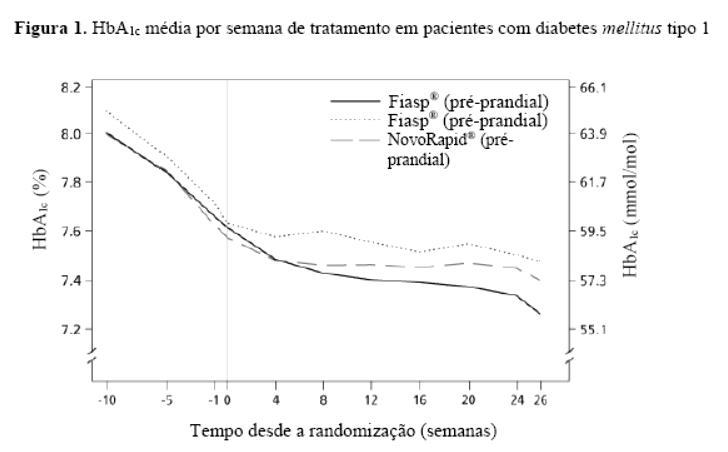
Em pacientes com diabetes mellitus tipo 1, Fiasp® proporcionou um maior controle glicêmico geral do que NovoRapid®. Fiasp® proporcionou um melhor controle glicêmico pós-prandial do que NovoRapid®, sem aumento no risco global de hipoglicemia grave ou confirmada em pacientes com diabetes mellitus tipo 1 ou tipo 2 (Tabela 1 e 2).
Pacientes com diabetes mellitus tipo 2:
Fiasp® foi efetivo no controle glicêmico em pacientes com diabetes mellitus tipo 2 (Tabela 2). Fiasp® em combinação com insulina basal diária e metformina resultou em uma redução superior na HbA1c e uma redução estatisticamente significativa na glicemia pós-prandial em pacientes com diabetes mellitus tipo 2 em comparação à insulina basal diária com metformina (Tabela 3).
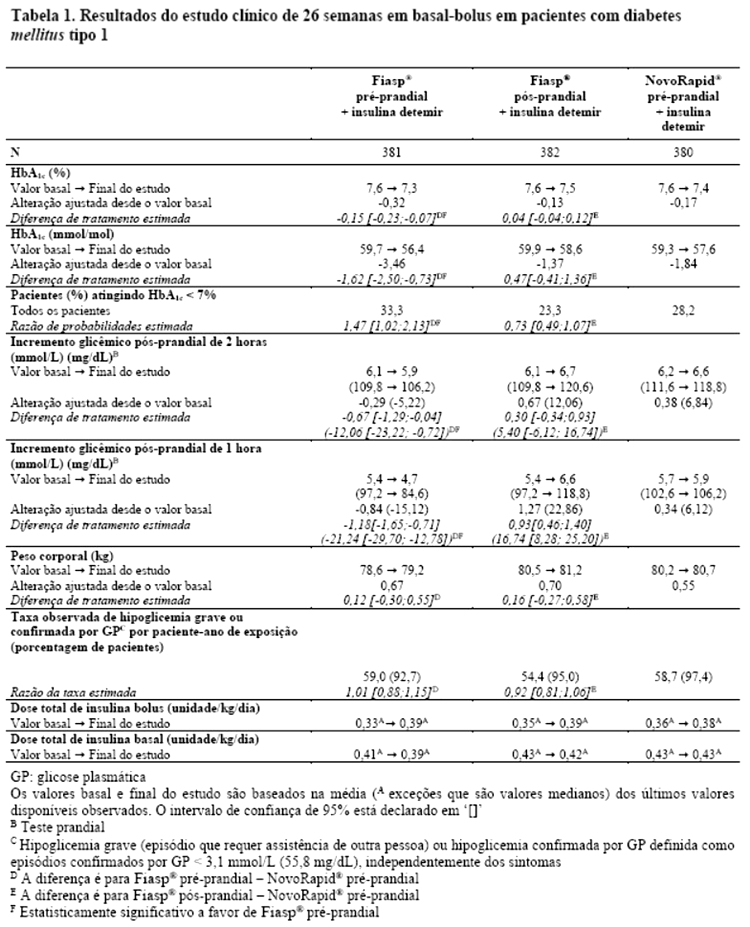
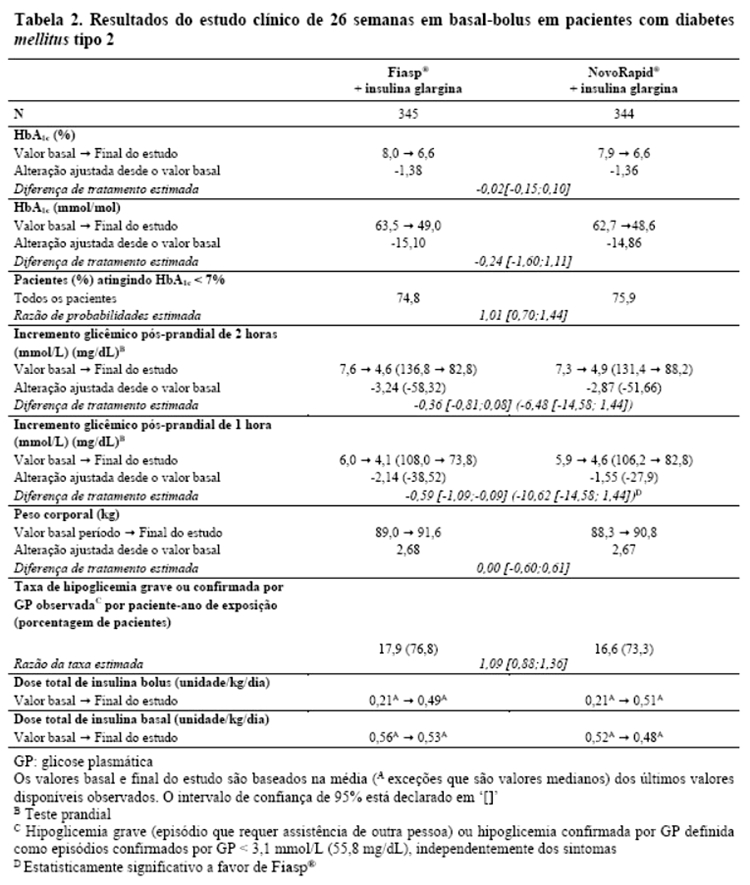
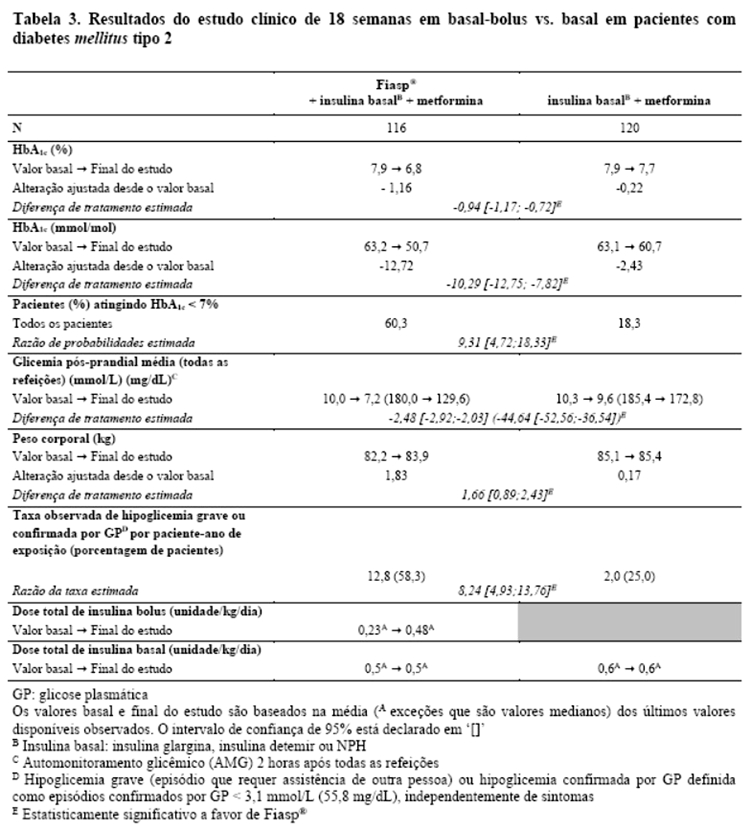
Idosos:
Nos três estudos clínicos controlados, 192 de 1219 (16%) pacientes com diabetes mellitus tipo 1 ou diabetes mellitus tipo 2 tratados com Fiasp® tinham ≥ 65 anos de idade e 24 de 1219 (2%) tinham ≥ 75 anos de idade. Nenhuma diferença geral na segurança ou eficácia foi observada entre pacientes idosos e mais jovens.
Infusão subcutânea contínua de insulina (CSII) (do inglês, Continuous Subcutaneous Insulin Infusion)
Um estudo de 6 semanas, randomizado (2:1), duplo-cego, de grupos paralelos com controle ativo avaliou a compatibilidade de Fiasp® e NovoRapid® administrados por meio do sistema CSII em pacientes adultos com diabetes mellitus tipo 1. Não houve episódios microscopicamente confirmados de oclusões no equipo de infusão nos grupos Fiasp® (n=25) ou NovoRapid® (n=12). Houve dois pacientes do grupo Fiasp® que relataram, cada um, duas reações no local de infusão decorrentes do tratamento.
• População pediátrica
A eficácia e segurança de Fiasp® foram avaliadas em um estudo clínico 1:1:1, randomizado, ativo-controlado, em crianças e adolescentes com diabetes mellitus tipo 1, entre 1 e 18 anos de idade, por um período de 26 semanas (n=777). Neste estudo, foram avaliadas a eficácia e segurança de Fiasp® administrado pré-prandial (0-2 minutos antes da refeição) ou pós-prandial (20 minutos após o início da refeição) e de NovoRapid® administrado pré-prandial, ambos em combinação com insulina degludeca. O desfecho primário foi a avaliação da alteração de HbA1c em relação ao valor basal 26 semanas após a randomização para todos os pacientes randomizados.
Este estudo clínico incluiu um período de triagem de 2 semanas, um período de "run-in" de 12 semanas (para otimização da insulina basal), um período de 26 semanas de tratamento e um período de 30 dias de acompanhamento. Durante o período de tratamento, a insulina em bolus foi titulada para o alvo glicêmico pré-prandial de 4,0-8,0 mmol/L (71-145 mg/dL) e alvo glicêmico na hora de dormir de 6,7-10,0 mmol/L (120-180 mg/dL), em uma abordagem de alvo de tratamento.
Os seguintes critérios de inclusão foram utilizados neste estudo clínico:
- Diagnóstico de DM1 (baseado em avaliação clínica e apoiado por análises laboratoriais de acordo com as diretrizes locais);
- Tratamento diário em andamento com um regime de insulina basal-bolus com uma insulina análoga basal ou NPH por pelo menos 90 dias antes da visita de triagem;
- HbA1c ≤9.5% (80 mmol/mol) analisado pelo laboratório central na visita de triagem.
Os pacientes no braço de Fiasp® pré-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 144 adolescentes entre 12 e 17 anos de idade. Os pacientes no braço de Fiasp® pós-prandial incluíram 16 crianças entre 2 e 5 anos, 100 crianças entre 6 e 11 anos e 143 adolescentes entre 12 e 17 anos de idade.
Fiasp® administrado pré-prandial demonstrou superioridade quando comparado a NovoRapid® em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: -0,17% [-0,30; -0,03] IC95%). Fiasp® administrado pós-prandial demonstrou não inferioridade quando comparado a NovoRapid®, em relação à alteração do nível basal de HbA1c, 26 semanas após a randomização (ETD: 0.13% [-0.01; 0.26] IC95%).
Foi observada diferença estatisticamente significativa a favor de Fiasp® administrado pré-prandial, quando comparado a NovoRapid® pré-prandial após 26 semanas, em relação ao nível basal de glicemia pós-prandial, 1 hora após o almoço e jantar. Para Fiasp® pós-refeição, foi observada diferença estatisticamente significativa a favor de NovoRapid® pré-prandial em relação a este parâmetro.
Não foi observado aumento geral do risco de hipoglicemia grave ou confirmada em comparação a NovoRapid®.
Os efeitos observados e os perfis de segurança foram comparáveis entre todos os grupos etários.
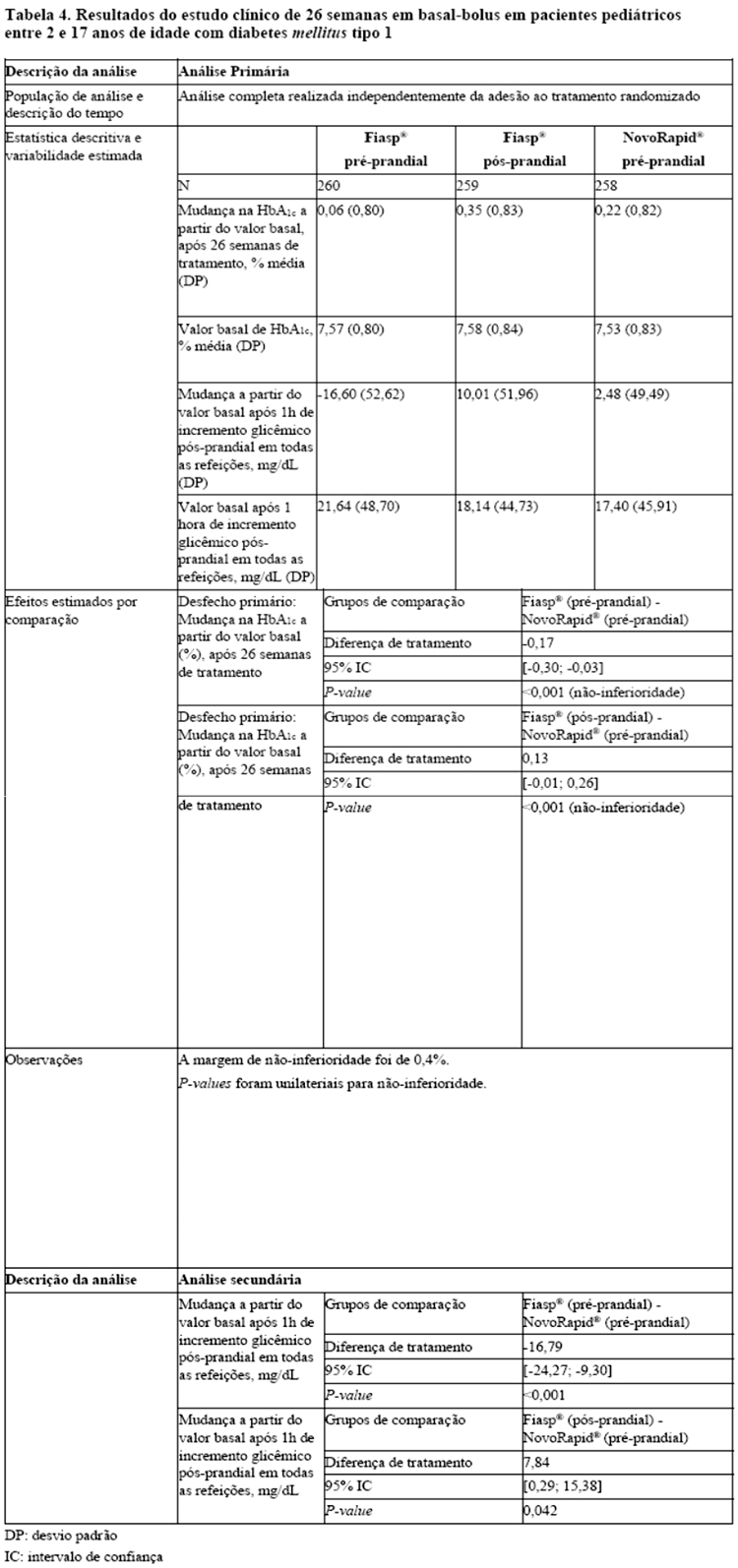
Referências:
1. Russell-Jones D, et al. Fast-Acting Insulin Aspart Improves Glycemic Control in Basal-Bolus Treatment for Type 1 Diabetes: Results of a 26-Week Multicenter, Active-Controlled, Treat-to-Target, Randomized, Parallel-Group Trial (onset 1). Diabetes Care 2017;40:943-950.
2. Bowering K, et al. Faster Aspart Versus Insulin Aspart as Part of a Basal-Bolus Regimen in Inadequately Controlled Type 2 Diabetes: The onset 2 Trial. Diabetes Care 2017;40:951-957.
3. Rodbard HW, et al. Adding fast-acting insulin aspart to basal insulin significantly improved glycaemic control in patients with type 2 diabetes: A randomized, 18-week, open-label, phase 3 trial (onset 3). Diabetes Obes Metab 2017;19:1389-1396.
4. Zijlstra E, et al. Investigation of Pump Compatibility of Fast-Acting Insulin Aspart in Subjects With Type 1 Diabetes. J Diabetes Sci Technol 2018;12(1):145-151.
5. Bode BW, et al. Efficacy and Safety of Fast-Acting Insulin Aspart Compared With Insulin Aspart, Both in Combination With Insulin Degludec, in Children and Adolescents With Type 1 Diabetes: The onset 7 Trial. Diabetes Care 2019;42(7):1255-1262.
3. CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades Farmacodinâmicas
Mecanismo de ação
A atividade primária de Fiasp® é a regulação do metabolismo da glicose.
As insulinas, incluindo insulina asparte, princípio ativo de Fiasp® , exercem a sua ação específica por meio da ligação aos receptores da insulina. A insulina ligada ao receptor reduz a glicemia facilitando a captação celular de glicose no músculo esquelético e no tecido adiposo, e inibindo a saída de glicose do fígado.
A insulina inibe a lipólise no adipócito, inibe a proteólise e aumenta a síntese de proteína.
Dados Farmacodinâmicos
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início de ação mais rápido e maior efeito hipoglicemiante inicial em comparação com NovoRapid®. Isso deve ser considerado ao prescrever Fiasp®.
O início de ação foi 5 minutos mais rápido e o tempo para a taxa de infusão máxima de glicose foi 11 minutos mais curto com Fiasp® do que com NovoRapid®. O efeito hipoglicêmico (AUCGIR) foi 74% maior durante os primeiros 30 minutos com Fiasp® do que com NovoRapid®.
O efeito hipoglicemiante total e o efeito hipoglicemiante máximo (GIRmax) foram comparáveis entre Fiasp® e NovoRapid®. O efeito hipoglicemiante total e o efeito hipoglicemiante máximo de Fiasp® aumentam linearmente com o aumento da dose dentro da faixa de dose terapêutica.
A duração de ação foi mais curta e o efeito hipoglicemiante tardio foi 10% menor para Fiasp® comparado com aquele de NovoRapid®.
Fiasp® injetado pré-prandial produziu um efeito hipoglicemiante pós-prandial significativamente maior após um teste prandial padronizado em comparação com NovoRapid®. A diferença de tratamento na redução do incremento glicêmico pós-prandial de 2 horas foi estatisticamente significativa em favor de Fiasp® (-0,67 mmol/L [-1,29; -0,04] IC95%) (-12,06 mg/dL [-23,22; -0,72] IC95%). A diferença de tratamento na redução do incremento glicêmico pós-prandial de 1 hora foi de -1,18 mmol/L [-1,65; -0,71] IC95% (-21,24 mg/dL [-29,70; -12,78] IC95%), consistente com o perfil de absorção mais rápido (vide Tabela 1, na seção "2. Resultados de eficácia" e Figura 2).
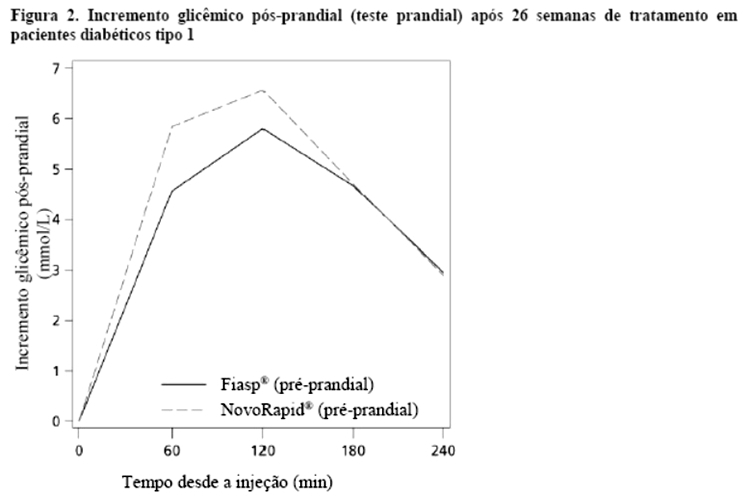
A variabilidade diária intraindividual no efeito hipoglicemiante foi baixa para Fiasp® para o efeito hipoglicemiante inicial (AUCGIR, 0-1h, CV~26%), total (AUCGIR, 0-12h, CV~18%) e máximo (GIRmax, CV 19%).
Infusão subcutânea contínua de insulina (CSII)
Fiasp® mostrou um efeito hipoglicemiante pós-prandial maior após um teste prandial padronizado com relação à resposta glicêmica pós-prandial (PPG, do inglês, Post-Prandial blood Glucose) de 1 hora e 2 horas (diferença de tratamento: -0,50 mmol/L [-1,07; 0,07] IC 95% (-9,00 mg/dL [-30,60; 1,26] IC95%) e -0,99 mmol/L [-1,95; -0,03] IC 95% (-17,82 mg/dL [-35,10; -0,54] IC95%), respectivamente em comparação com NovoRapid® (Figura 3) em um contexto de CSII.
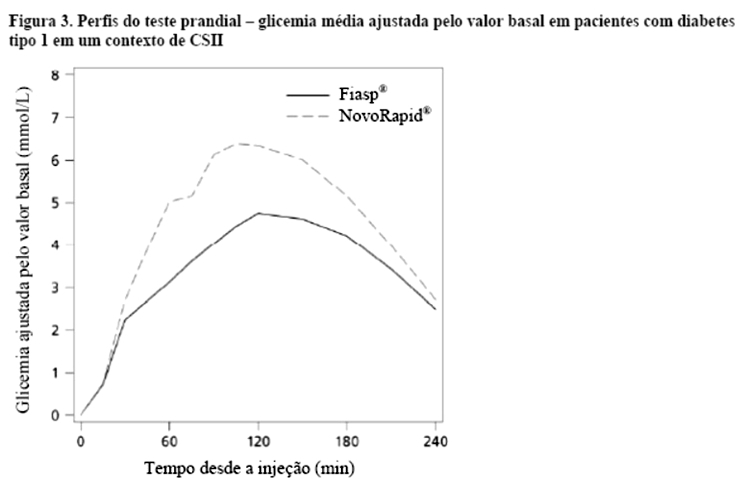
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de ação mais rápido e um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo semelhante em comparação com NovoRapid®.
O efeito hipoglicemiante total e máximo com Fiasp® foi comparável entre idosos e mais jovens.
Obesidade:
O efeito do IMC na farmacodinâmica de Fiasp® foi explorado em uma análise transversal de estudos farmacodinâmicos. Fiasp® teve um efeito hipoglicemiante inicial maior, mantendo um efeito hipoglicemiante total e máximo comparável a NovoRapid® nos níveis de IMC em pacientes com diabetes mellitus tipo 1. Uma tendência para redução no efeito hipoglicemiante de Fiasp® com o aumento no IMC foi observada em pacientes com diabetes mellitus tipo 1.
Propriedades Farmacocinéticas
Absorção:
Fiasp® é uma formulação de insulina asparte para uso na hora da refeição, cuja adição de nicotinamida (vitamina B3) resulta em uma absorção inicial mais rápida de insulina, levando a um início mais rápido de exposição e maior exposição inicial à insulina após a administração em bolus por meio da injeção subcutânea (Figura 4, Tabela 4) ou por meio de CSII em bombas (Figura 5) em comparação com NovoRapid®.
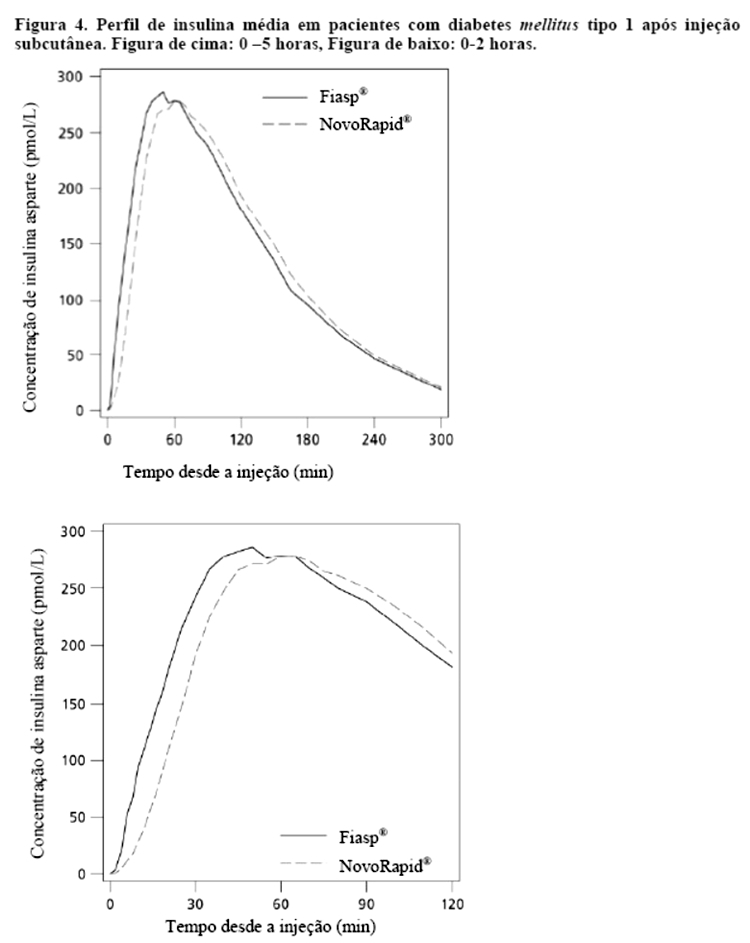
Após administração de Fiasp®, a insulina apareceu na circulação aproximadamente 4 minutos após a administração. O início do aparecimento foi duas vezes mais rápido (correspondendo a 5 minutos mais cedo), o tempo até 50% da concentração máxima foi 9 minutos mais curto com Fiasp® comparado a NovoRapid® com o dobro da insulina disponível durante os primeiros 30 minutos (Tabela 5). A exposição total à insulina (AUCinsulina asparte, 0-12horas) e a concentração máxima de insulina (Cmax) foram comparáveis entre Fiasp® e NovoRapid®. A exposição total e a concentração máxima de insulina aumentam de maneira proporcional com o aumento da dose subcutânea de Fiasp® dentro da faixa de dose terapêutica.

Infusão subcutânea contínua de insulina (CSII):
O início da exposição em um contexto de CSII (tempo até atingir a concentração máxima) foi 26 minutos mais curto com Fiasp® em comparação a NovoRapid®, resultando em aproximadamente três vezes mais insulina disponível durante os primeiros 30 minutos (Figura 5). A duração da exposição (tempo de atraso 50% Cmax) foi 35 minutos mais curta com Fiasp® comparado a NovoRapid®.
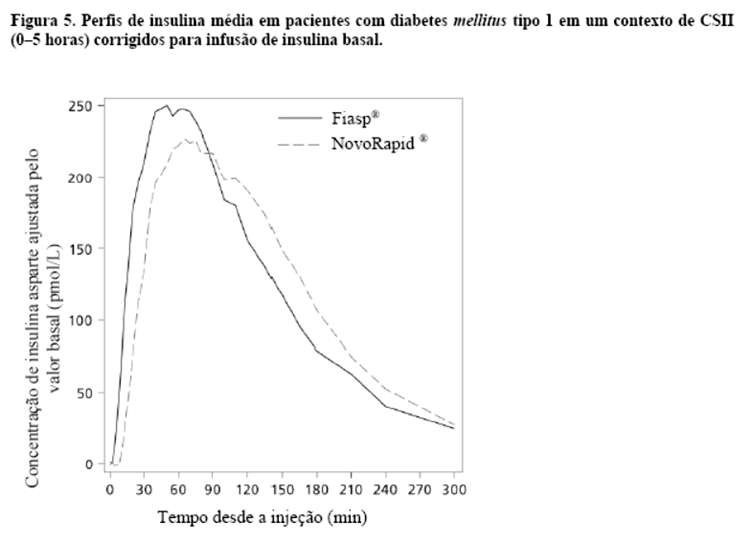
Distribuição:
A insulina asparte possui uma baixa afinidade de ligação a proteínas plasmáticas ( < 10%), semelhante àquela observada com a insulina humana regular.
Biotransformação:
A degradação de insulina asparte é semelhante àquela da insulina humana.
Eliminação:
A meia-vida após a administração subcutânea de Fiasp® é de 57 minutos e comparável à de NovoRapid®.
Idosos:
Em pacientes idosos com diabetes mellitus tipo 1, Fiasp® mostrou um início de exposição mais rápido e uma exposição à insulina inicial maior, mantendo uma exposição total e uma concentração máxima semelhantes, comparada com NovoRapid®.
O efeito da idade na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Não foi observada relação entre exposição total à insulina de Fiasp® e idade (faixa etária entre 18-83 anos).
Sexo:
O efeito do sexo na farmacocinética de Fiasp® foi avaliado cruzando-se os dados de todos os estudos de farmacocinética. Fiasp® mostrou um início de exposição mais rápido comparável e uma exposição à insulina inicial mais alta, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid® para pacientes do sexo feminino e masculino com diabetes mellitus tipo 1.
A exposição inicial e máxima à insulina de Fiasp® foi comparável entre pacientes do sexo feminino e masculino com diabetes mellitus tipo 1. No entanto, a exposição total à insulina foi maior em pacientes do sexo feminino em comparação à do sexo masculino com diabetes mellitus tipo 1.
Obesidade:
O efeito do IMC na farmacocinética de Fiasp® foi explorado em uma análise cruzada de estudos farmacocinéticos. Para pacientes com diabetes mellitus tipo 1, a maior exposição inicial à insulina para Fiasp® comparada a NovoRapid® foi conservada nos níveis de IMC e esta diferença de tratamento aumentou com o aumento do IMC. A exposição total e máxima à insulina foi comparável entre Fiasp® e NovoRapid® nos níveis de IMC.
O efeito do IMC na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Nenhuma relação entre exposição total à insulina de Fiasp® e IMC foi observada.
Raça e Etnia:
O efeito da raça e etnia (negros versus brancos e hispânicos versus não hispânicos) na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. Para Fiasp®, nenhuma diferença em exposição foi encontrada entre os grupos raciais e étnicos investigados.
Insuficiência hepática:
Um estudo de farmacocinética de dose única de insulina asparte foi realizado em 24 indivíduos com função hepática variando de normal a gravemente comprometida. Em participantes do estudo com comprometimento hepático, a taxa de absorção foi reduzida e mais variável.
Insuficiência renal:
O efeito do comprometimento renal na exposição total à insulina de Fiasp® foi baseado nos resultados de uma análise de farmacocinética populacional em pacientes com diabetes mellitus tipo 1. A função renal foi definida usando clearance de creatinina (CLcr) como segue: ≥90 mL/min (normal)(N=546), 60-89 mL/min (leve)(N=115), 30-59 mL/min (moderado)(N=21). A exposição total mais alta foi observada com decréscimo na função renal para Fiasp®. No entanto, houve alguma variabilidade entre participantes do estudo na exposição total nos pacientes com diabetes mellitus tipo 1 com comprometimento renal leve ou moderado.
Portanto, como com todas as insulinas, o monitoramento glicêmico deve ser intensificado e a dose de Fiasp® ajustada individualmente em pacientes com insuficiência renal.
População pediátrica:
Em crianças (6-11 anos) e adolescentes (12-18 anos), Fiasp® mostrou um início mais rápido de exposição e uma exposição inicial mais alta à insulina, mantendo uma exposição total e concentração máxima semelhantes em comparação com NovoRapid®.
O início de ação e a exposição inicial a Fiasp® foram similares entre crianças, adolescentes e adultos. A exposição total a Fiasp® foi menor em crianças e adolescentes em comparação com adultos quando administradas 0,2 unidades/kg de peso corporal, enquanto a concentração plasmática máxima de insulina asparte foi similar entre todos os grupos etários.
Dados de segurança pré-clínico
Dados não clínicos não revelaram risco especial para seres humanos com base nos estudos convencionais de farmacologia de segurança, toxicidade de dose repetida, genotoxicidade e toxicidade de reprodução após a exposição à insulina asparte.
Em testes in vitro, incluindo ligação à insulina, sítios de receptor de IGF-1 e efeitos no crescimento celular, a insulina asparte se comportou de uma maneira semelhante à insulina humana. Estudos também demonstram que a dissociação da ligação da insulina asparte ao receptor de insulina é equivalente a da insulina humana.
4. CONTRAINDICAÇÕES
- Hipersensibilidade a substância ativa ou a qualquer um dos excipientes (vide seção "Composição");
- Pacientes apresentando sintomas de hipoglicemia (vide seção "9. Reações Adversas").
5. ADVERTÊNCIAS E PRECAUÇÕES
Antes de viajar entre zonas de fuso horário diferente, o paciente deve procurar orientação médica, já que isso pode significar que o paciente deve usar a insulina e fazer as refeições em períodos diferentes.
Hipoglicemia:
A omissão de uma refeição ou exercício físico não planejado e extenuante pode levar à hipoglicemia.
A hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina (vide seção "9. Reações Adversas" e "10. Superdose").
Os pacientes cujo controle glicêmico é amplamente melhorado, por exemplo, pela insulinoterapia intensificada, podem apresentar uma alteração nos seus sintomas habituais de alerta da hipoglicemia, e devem ser aconselhados de acordo. Os sintomas habituais de alerta podem desaparecer em pacientes com diabetes mellitus de longa data.
O momento da hipoglicemia geralmente reflete o perfil de tempo-ação da formulação da insulina administrada. Fiasp® possui um perfil de tempo de ação distinto (vide seção "Mecanismo de ação") o que impacta o momento da hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que se ocorrer a hipoglicemia, ela pode ocorrer mais cedo após uma injeção/infusão quando comparado com outras insulinas prandiais.
Como Fiasp® deve ser administrado no início de uma refeição ou no pós-prandial (dentro de 20 minutos após iniciar uma refeição), o rápido início de ação deve, portanto, ser considerado em pacientes com esvaziamento gástrico atrasado.
Este medicamento não deve ser usado enquanto o paciente apresentar sintomas de hipoglicemia.
População pediátrica
O monitoramento rigoroso da glicemia é recomendado se este medicamento for administrado após o início da última refeição do dia, para evitar hipoglicemia noturna.
Hiperglicemia:
O uso de doses inadequadas ou a descontinuação do tratamento, especialmente em pacientes que necessitam de insulina, pode levar à hiperglicemia e à cetoacidose diabética, condições que são potencialmente letais.
Infusão subcutânea contínua de insulina (CSII):
Defeitos na bomba ou no equipamento de infusão podem levar a um início rápido de hiperglicemia e cetose. A identificação imediata e a correção da causa da hiperglicemia ou cetose são necessárias. Terapia interina com injeção subcutânea pode ser necessária.
Doenças concomitantes:
Doenças concomitantes renais, hepáticas ou que afetam as glândulas suprarrenais, hipófise ou tireoide podem exigir modificações na dose de insulina.
Transferência de outras insulinas:
Vide seção "8. Posologia e modo de usar".
Em combinação com tiazolidinedionas e insulinas:
Casos de insuficiência cardíaca congestiva foram relatados quando as tiazolidinedionas foram usadas em combinação com insulina, especialmente em pacientes com fatores de risco para o desenvolvimento de insuficiência cardíaca congestiva. Isto deve ser considerado se o tratamento com a combinação de tiazolidinedionas e insulina for considerado. Se a combinação for usada, os pacientes devem ser observados para sinais e sintomas de insuficiência cardíaca congestiva, ganho de peso e edema. Tiazolidinedionas devem ser descontinuadas se ocorrer qualquer deterioração nos sintomas cardíacos.
Iniciação da insulina e intensificação do controle glicêmico:
A intensificação ou melhora rápida no controle glicêmico foi associada a um transtorno transitório e reversível de refração oftalmológica, piora da retinopatia diabética, neuropatia periférica aguda dolorosa e edema periférico. No entanto, o controle glicêmico de longo prazo reduz o risco de retinopatia e neuropatia diabética.
Anticorpos contra insulina:
A administração de insulina pode causar a formação de anticorpos contra insulina. Em casos raros, a presença de tais anticorpos contra insulina pode ocasionar a necessidade de ajuste da dose de insulina para corrigir uma tendência para hiper ou hipoglicemia.
Prevenção de misturas acidentais / erros de medicação:
Os pacientes devem ser instruídos a verificar sempre o rótulo da insulina antes de cada injeção, para evitar misturas acidentais entre Fiasp® e outras insulinas.
Os pacientes devem verificar visualmente as unidades da dose antes da administração de Fiasp®. Portanto, o requisito para a autoadministração por pacientes é que eles possam ler a escala de dose. Os pacientes que são cegos ou têm pouca visão devem ser instruídos a sempre obter assistência de outra pessoa que tenha boa visão e esteja treinada na administração de insulinas.
Efeitos na capacidade de dirigir e operar máquinas:
A capacidade do paciente de se concentrar e reagir pode ser prejudicada como resultado da hipoglicemia. Isto pode constituir um risco em situações em que essas habilidades sejam de importância especial (por exemplo, dirigir um carro ou operar máquinas).
Os pacientes devem ser aconselhados a tomar precauções para evitar a hipoglicemia ao dirigir. Isto é particularmente importante para aqueles que têm pouco ou nenhum conhecimento dos sinais de alerta para hipoglicemia ou que têm episódios frequentes de hipoglicemia. A conveniência de dirigir deve ser considerada nessas circunstâncias.
Informações referentes à fertilidade, gravidez e amamentação
Fertilidade:
Estudos de reprodução em animais não revelaram diferenças entre a insulina asparte e a insulina humana em relação à fertilidade.
Gravidez:
Não há dados disponíveis com o uso de Fiasp® em mulheres grávidas para informar um risco associado ao medicamento para defeitos congênitos maiores e aborto. Informações disponíveis de estudos randomizados-controlados com o uso de insulina asparte durante o segundo trimestre de gravidez não demonstraram uma associação entre a insulina asparte e defeitos congênitos maiores, desfechos adversos materno ou desfechos adversos fetais. Existem riscos para a mãe e o feto associados ao diabetes mal controlado na gravidez.
O controle glicêmico intensificado e o monitoramento de mulheres grávidas com diabetes mellitus (diabetes mellitus tipo 1, diabetes mellitus tipo 2 ou diabetes mellitus gestacional) são recomendados duran
te toda a gravidez e quando pretende-se engravidar. As necessidades de insulina geralmente diminuem no primeiro trimestre e aumentam subsequentemente durante o segundo e terceiro trimestre. Após o parto, normalmente as necessidades de insulina retornam rapidamente aos valores pré-gestacionais.
Categoria de risco na gravidez: A
Este medicamento pode ser utilizado durante a gravidez desde que sob prescrição médica ou do cirurgião-dentista.
Amamentação:
Não existem restrições no tratamento com Fiasp® durante a amamentação. O tratamento da mãe lactante com insulina não apresenta risco ao bebê. No entanto, a dose de Fiasp® pode precisar ser ajustada.
Este medicamento pode causar doping.
6. INTERAÇÕES MEDICAMENTOSAS
Alguns medicamentos são conhecidos por interagir com o metabolismo da glicose.
As substâncias a seguir podem reduzir a necessidade de insulina:
Medicamentos antidiabéticos orais, inibidores da monoaminoxidase (IMAO), betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), salicilatos, esteroides anabolizantes, sulfonamidas e agonista do receptor de GLP-1.
As substâncias a seguir podem aumentar a necessidade de insulina:
Contraceptivos orais, tiazidas, glicocorticoides, hormônios tireoidianos, simpatomiméticos, hormônio do crescimento e danazol.
Os agentes betabloqueadores podem mascarar os sintomas da hipoglicemia.
A octreotida/lanreotida podem aumentar ou diminuir as necessidades de insulina.
O álcool pode intensificar ou reduzir o efeito hipoglicêmico da insulina.
7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Antes do primeiro uso:
Armazenar sob refrigeração (entre 2°C e 8°C). Mantenha distante do compartimento do congelador. Não congelar. Mantenha o carpule na embalagem para protegê-lo da luz. Este medicamento tem prazo de validade de 30 meses.
Após o primeiro uso ou carregado como reserva:
Válido por 4 semanas, quando armazenado em temperaturas de até 30°C.
Não refrigerar. Não congelar. Mantenha o carpule na embalagem para protegê-lo da luz.
Não armazene o produto sob temperaturas acima de 30°C.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Número de lote e datas de fabricação e validade: vide embalagem.
A data de validade se refere ao último dia do mês indicado.
Fiasp® é uma solução aquosa injetável límpida e incolor.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
8. POSOLOGIA E MODO DE USAR
Método de administração:
Fiasp® Penfill® está disponível em carpules e foi desenvolvido para ser utilizado com sistemas de aplicação de insulina da Novo Nordisk e agulhas descartáveis NovoFine®.
Injeção subcutânea:
Fiasp® é administrado pela via subcutânea na parede abdominal, na parte superior do braço ou na coxa. Os locais de injeção devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia.
A duração da ação de Fiasp® pode variar de acordo com a dose, local da injeção, fluxo sanguíneo, temperatura e nível de atividade física.
Infusão subcutânea contínua de insulina (CSII):
Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas adequadas para infusão de insulina. Fiasp® pode ser administrado de acordo com as instruções fornecidas pelo fabricante da bomba, de preferência no abdômen. Os locais de infusão devem ser alternados dentro da mesma região para reduzir o risco de lipodistrofia. Quando usado com uma bomba de infusão de insulina, Fiasp® não deve ser diluído ou misturado com outras insulinas.
Os pacientes que usam CSII devem ser orientados sobre o uso da bomba com o reservatório e tubo corretos. O equipo de infusão (tubo e cânula) deve ser trocado de acordo com as instruções do produto fornecidas com o equipo de infusão.
Pacientes que administram Fiasp® por CSII devem ser treinados para administrar insulina por injeção e ter a insulinoterapia alternativa disponível em caso de falha da bomba.
Uso intravenoso:
Se necessário, Fiasp® pode ser administrado pela via intravenosa por profissionais de saúde.
Para uso intravenoso, Fiasp® deve ser usado em concentrações de 0,5 unidade/mL a 1,0 unidade/mL de insulina asparte em sistemas de infusão usando bolsas de infusão de polipropileno. Fiasp® demonstrou ser estável em temperatura ambiente por 24 horas nos líquidos de infusão, como cloreto de sódio 0,9% ou dextrose 5%. O monitoramento da glicemia é necessário durante a infusão de insulina. Deve-se tomar cuidado para assegurar que a insulina seja injetada na bolsa de infusão e não simplesmente no acesso de entrada da bomba.
Não há dados de segurança e eficácia da utilização intravenosa de Fiasp® em crianças.
Precauções especiais para manuseio e descarte:
As agulhas e Fiasp® Penfill® não devem ser compartilhados. O carpule não deve ser preenchido.
Fiasp® não deve ser usado se a solução não estiver límpida e incolor.
Fiasp® não deve ser usado se foi congelado.
O paciente deve descartar a agulha após cada aplicação.
Qualquer resíduo deve ser descartado de acordo com as exigências locais.
Para casos de emergência (hospitalização ou mal funcionamento do sistema de aplicação) em pacientes que utilizam Fiasp®, o medicamento pode ser extraído do carpule com a ajuda de uma seringa de 100 U de insulina.
Incompatibilidades:
Substâncias adicionadas a Fiasp® podem causar a degradação da insulina asparte.
Fiasp® não deve ser diluído ou misturado com outros medicamentos, exceto em casos de fluídos para infusão, conforme descrito no item "Método de administração".
Posologia:
Fiasp® é uma insulina para administração subcutânea pré-prandial ou pós-prandial (em até 20 minutos após iniciar uma refeição). Além disso, Fiasp® pode ser usado em infusão subcutânea contínua de insulina (CSII) em bombas de infusão ou ser administrado por via intravenosa por profissionais de saúde.
A potência dos análogos da insulina, incluindo Fiasp®, é expressa em unidades. Uma (1) unidade de Fiasp® corresponde a 1 unidade internacional de insulina humana ou 1 unidade de outros análogos da insulina de ação rápida.
A posologia de Fiasp® é individual e determinada de acordo com as necessidades do paciente.
- Terapia por injeção: Fiasp® deve ser usada em combinação com insulina de ação intermediária ou longa administrada pelo menos uma vez ao dia. Em um regime de tratamento basal-bolus, aproximadamente 50% desta necessidade pode ser fornecida por Fiasp® e o restante pela insulina de ação intermediária ou longa.
- CSII: Fiasp® pode ser usado para infusão subcutânea contínua de insulina (CSII) em bombas. Neste caso, Fiasp® cobrirá a necessidade da insulina bolus (aproximadamente 50%) e da insulina basal.
O monitoramento da glicemia e o ajuste na dose de insulina são recomendados para atingir o controle glicêmico ideal.
A necessidade individual de insulina diária total em adultos, adolescentes e crianças pode variar e é geralmente entre 0,5 e 1,0 unidade/kg/dia.
O ajuste da dose pode ser necessário se os pacientes aumentarem a atividade física, modificarem a sua dieta habitual ou durante doença concomitante. Os níveis glicêmicos devem ser monitorados de modo adequado sob essas condições.
O início de ação mais rápido deve ser considerado ao prescrever Fiasp® (vide seção "3. Características farmacológicas").
Iniciação
Pacientes com diabetes mellitus tipo 1:
A dose inicial recomendada de Fiasp® em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina é de aproximadamente 50% da dose total de insulina diária e deve ser dividida entre cada refeição diária. O restante da dose total de insulina diária deve ser administrado como insulina de ação intermediária ou longa. Como regra geral, 0,2 a 0,4 unidades de insulina por quilograma de peso corporal podem ser usadas para calcular a dose inicial de insulina diária total em pacientes com diabetes mellitus tipo 1 sem tratamento prévio com insulina.
Pacientes com diabetes mellitus tipo 2:
A dose inicial sugerida é de 4 unidades em uma ou mais refeições. O número de injeções e a titulação subsequente dependerão do alvo glicêmico individual.
Transferência de outra insulina
Recomenda-se o monitoramento glicêmico rigoroso durante a transferência de outras insulinas para uso na hora da refeição e nas semanas iniciais seguintes.
A conversão de outra insulina para uso na hora da refeição pode ser feita unidade por unidade. Devido ao início mais rápido de ação da insulina, Fiasp® deve ser injetado no início de uma refeição ou depois (em até 20 minutos após o início de uma refeição).
A transferência de um paciente de outro tipo, marca ou fabricante de insulina para Fiasp® deve ser feita sob supervisão médica e pode resultar na necessidade para uma modificação na dose.
Doses e horários das insulinas de ação intermediária ou longa concomitantes ou outro tratamento antidiabético concomitante podem precisar ser ajustados.
Pacientes com diabetes mellitus tipo 2
O ajuste de Fiasp® pode ser considerado diariamente com base no AMG (Automonitoramento Glicêmico) na hora da refeição e na hora de dormir do dia anterior de acordo com a Tabela 5.
• O Fiasp® pré-desjejum deve ser ajustado de acordo com o AMG pré-almoço do dia anterior.
• O Fiasp® pré-almoço deve ser ajustado de acordo com o AMG pré-jantar do dia anterior.
• O Fiasp® pré-jantar deve ser ajustado de acordo com o AMG na hora de dormir no dia anterior.
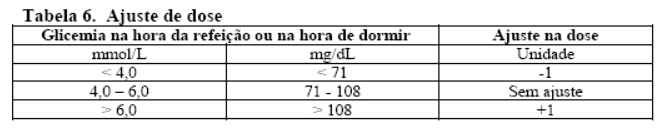
Idosos (≥ 65 anos de idade)
A segurança e eficácia de Fiasp® foram estabelecidas em pacientes idosos. Recomenda-se o monitoramento rigoroso da glicemia, e a dose de insulina deve ser ajustada individualmente (vide seção "3. Características Farmacológicas" e seção "2. Resultados de Eficácia").
Insuficiência renal e hepática
A insuficiência renal ou hepática pode reduzir as necessidades de insulina do paciente. Em pacientes com insuficiência renal ou hepática, o monitoramento glicêmico deve ser intensificado e a dose ajustada individualmente (vide seção "3. Características Farmacológicas").
População pediátrica
Fiasp® pode ser usado por adolescentes e crianças a partir de 1 ano de idade (vide seção "2. Resultados de eficácia"), substituindo a insulina humana regular quando um início de ação rápido for necessário, por exemplo, nos horários de aplicação da insulina prandial (vide seção "3. Características farmacológicas", itens "Propriedade farmacodinâmicas" e "Propriedades farmacocinéticas"). Fiasp® não foi avaliado para uso em crianças abaixo de 1 ano de idade e em crianças com diabetes mellitus tipo 2.
Não há experiência clínica com o uso de Fiasp® em crianças menores de 2 anos de idade.
Recomenda-se que Fiasp® seja administrado antes da refeição (0-2 minutos), com a flexibilidade de administrar em até 20 minutos após o início da refeição, quando existe incerteza sobre o consumo alimentar.
Dose esquecida
Pacientes em tratamento basal-bolus que esqueceram uma dose na hora da refeição devem ser aconselhados a monitorar o seu nível glicêmico para decidir se uma dose de insulina é necessária. Os pacientes devem retomar o seu esquema habitual de dose na próxima refeição.
9. REAÇÕES ADVERSAS
As reações adversas listadas nesta seção são consideradas esperadas para este medicamento.
Resumo do perfil de segurança
A reação adversa relatada com mais frequência durante o tratamento foi a hipoglicemia (vide item "Descrição das reações adversas selecionadas").
Reações adversas de estudos clínicos
As reações adversas listadas a seguir são baseadas em dados de seis estudos confirmatórios terapêuticos em adultos. Fiasp® foi comparado a NovoRapid® em cinco destes estudos, e comparado com insulina basal somente em um estudo. Nos seis estudos, 2163 pacientes foram tratados com Fiasp®; 1707 com diabetes mellitus tipo 1, dos quais 261 usando CSII, e 456 com diabetes mellitus tipo 2 (vide seção "2. Resultados de eficácia" para mais detalhes sobre os estudos). As reações adversas são classificadas de acordo com a Classe de Sistemas de Órgãos MedDRA. As categorias de frequência são definidas de acordo com a seguinte convenção: Muito comum (≥ 1/10); comum (≥ 1/100 a < 1/10); incomum (≥ 1/1.000 a < 1/100), rara (≥ 1/10,000 a < 1/1,000); muito rara ( < 1/10,000) e frequência desconhecida (não pode ser estimada com os dados disponíveis).
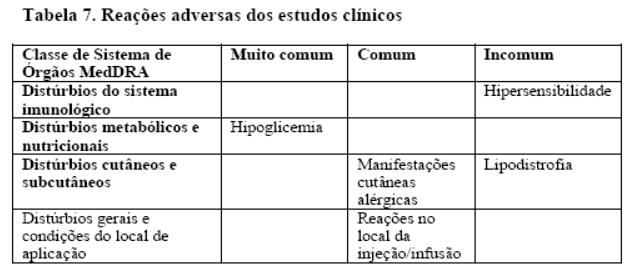
Descrição das reações adversas selecionadas
Reações alérgicas
Manifestações cutâneas alérgicas relatadas com Fiasp® (1,8% vs. 1,5% para comparador) incluem eczema, erupção cutânea, erupção cutânea prurítica, urticária e dermatite.
Com Fiasp®, reações de hipersensibilidade generalizada (manifestadas por erupção cutânea generalizada e edema facial) foram relatadas como incomum (0,2% vs. 0,3% para comparador). Com base nos dados obtidos após comercialização, formas graves de reações alérgicas sistêmicas podem ocorrer. Reações alérgicas do tipo imediato à insulina em si ou aos excipientes podem potencialmente ser de risco à vida.
Hipoglicemia
Hipoglicemia pode ocorrer se a dose de insulina for muito alta em relação à necessidade de insulina. Hipoglicemia grave pode levar à inconsciência e/ou convulsões e pode resultar em comprometimento temporário ou permanente da função cerebral ou até mesmo morte. Os sintomas de hipoglicemia geralmente ocorrem repentinamente. Eles podem incluir suores frios, pele pálida fria, fadiga, nervosismo ou tremor, ansiedade, cansaço ou fraqueza incomum, confusão, dificuldade de concentração, sonolência, fome excessiva, alterações de visão, cefaleia, náusea e palpitação. O tempo de hipoglicemia geralmente reflete o perfil tempo-ação da formulação de insulina administrada. Fiasp® possui um perfil de ação diferenciado (vide seção "Propriedades Farmacocinéticas/Propriedades Farmacodinâmicas"), que afeta o tempo de hipoglicemia. Uma consequência da farmacodinâmica do Fiasp® é que, se houver hipoglicemia, pode ocorrer mais cedo após uma injeção/infusão de Fiasp® em comparação com outras insulinas prandiais.
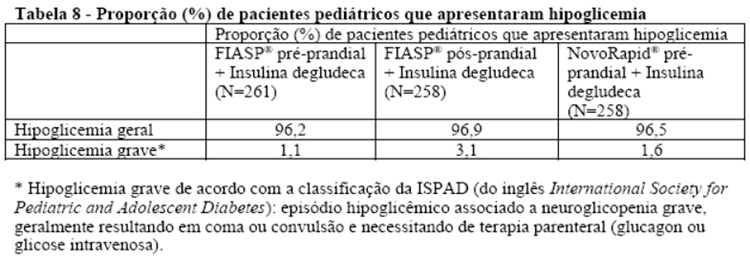
Lipodistrofia
Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) foi relatada no local da injeção/infusão em pacientes tratados com Fiasp® (0,5% vs. 0,2% no comparador). A rotação contínua do local da injeção dentro de uma mesma região em particular pode ajudar a reduzir o risco de desenvolver essas reações.
Reações no local da aplicação
Reações no local da injeção (incluindo erupção cutânea, rubor, inflamação, dor e hematoma) foram relatadas em pacientes tratados com Fiasp® (1,3% vs. 1,0% no comparador). Reações no local da infusão (incluindo rubor, inflamação, irritação, dor, hematoma e coceira) foram relatadas em pacientes tratados com Fiasp® (10,0% vs 8,3% no comparador). Essas reações são geralmente leves e transitórias e normalmente desaparecem durante o tratamento continuado.
População pediátrica
A eficácia e segurança foram investigadas em um estudo terapêutico confirmatório com crianças de 2 a 18 anos de idade, com diabetes mellitus tipo 1. No estudo, 519 pacientes foram tratados com Fiasp®. No geral, a frequência, o tipo e a gravidade das reações adversas na população pediátrica não indicaram diferenças quanto à experiência na população adulta. Lipodistrofia (incluindo lipohipertrofia, lipoatrofia) no local da injeção foi relatada mais frequentemente no estudo com pacientes pediátricos em comparação com os estudos com adultos (veja acima). Na população pediátrica, lipodistrofia foi relatado com frequência de 2,1% para pacientes em uso de Fiasp® versus 1,6% para pacientes em uso de NovoRapid®.
Outras populações especiais
Com base nos resultados de estudos clínicos, a frequência, tipo e gravidade das reações adversas observadas em pacientes idosos e em pacientes com comprometimento renal ou hepático não indicam diferenças na experiência mais ampla na população geral. Fiasp® foi administrado a pacientes idosos para investigação das propriedades farmacocinéticas (vide seção "3. Características Farmacológicas").
Imunogenicidade
Como para todas as terapias derivadas de proteínas, existe um potencial de imunogenicidade. A detecção da formação de anticorpos é altamente dependente da sensibilidade e especificidade do teste e pode ser influenciada por diversos fatores, como: metodologia do teste, manuseio da amostra, tempo de coleta da amostra, medicação concomitante e doença pré-existente. Por estes motivos, a comparação da incidência de anticorpos contra Fiasp® nos estudos descritos abaixo com a incidência de anticorpos em outros estudos ou contra outros produtos pode ser enganosa.
Em um estudo de 26 semanas com pacientes adultos com diabetes tipo 1, entre os 763 pacientes que receberam Fiasp®, 97,2% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 90,3% que resultaram positivos no início do estudo. Um total de 24,8% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 17,3% que foram positivos no início do estudo.
Em um estudo de 26 semanas com pacientes pediátricos com diabetes tipo 1, entre os 519 pacientes que receberam Fiasp®, 97,1% resultaram positivos para anticorpos anti-insulina (IAA) de reação cruzada pelo menos uma vez durante o estudo, incluindo 94,6% que resultaram positivos no início do estudo. Um total de 19,1% dos pacientes que receberam Fiasp® resultaram positivo para anticorpos ADA (do inglês anti-drugs antibodies) de insulina asparte pelo menos uma vez durante o estudo, incluindo 16,0% que foram positivos no início do estudo.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique ao Sistema de Notificação de Eventos Adversos a Medicamentos -VIGIMED, disponível em http://portal.anvisa.gov.br/vigimed, ou para a Vigilância Sanitária Estadual ou Municipal.
10. SUPERDOSE
As reações adversas listadas nesta seção são consideradas esperadas com o uso deste medicamento. Uma superdose específica para insulina não pode ser definida, no entanto, a hipoglicemia pode se desenvolver ao longo de estágios sequenciais se um paciente receber mais insulina do que o necessário:
Os episódios hipoglicêmicos leves podem ser tratados por administração oral de glicose ou outros produtos contendo açúcar. Recomenda-se, portanto, que o paciente com diabetes sempre carregue produtos contendo glicose.
Episódios hipoglicêmicos graves, em que o paciente não pode se tratar, podem ser tratados com glucagon (0,5 a 1 mg), administrado por via intramuscular ou subcutânea por uma pessoa treinada, ou com glicose administrada por via intravenosa por um profissional de saúde. A glicose deve ser administrada por via intravenosa se o paciente não responder ao glucagon dentro de 10 a 15 minutos. Após recobrar a consciência, recomenda-se a administração de carboidratos orais ao paciente para prevenir uma recidiva.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Dizeres legais.
Registro MS 1.1766.0035
VENDA SOB PRESCRIÇÃO MÉDICA
Esta bula foi aprovada pela ANVISA em 30/09/2019.

