CLAVULIN
GLAXOSMITHKLINE
amoxicilina + clavulânico, ácido
Antibiótico.
Uso adulto e pediátrico.
Apresentações.
Comp. revest. emb. c/12 ou 18. Susp. oral fco. c/75ml.
Composição.
Cada comp. revest.: amoxicilina 500mg, ácido clavulânico (sob a forma de clavulanato de potássio) 125mg. Susp. oral 125mg: amoxicilina 125mg, ácido clavulânico (sob a forma de clavulanato de potássio) 31,25mg por 5ml. Susp. oral 250mg: amoxicilina 250mg, ácido clavulânico (sob a forma de clavulanato de potássio) 62,5mg por 5ml.
Informações ao paciente.
Conservar o produto ao abrigo da luz, umidade e calor excessivo (temperatura não superior a 25°C). A suspensão oral, após reconstituição, ficará estável por 7 dias, devendo, no entanto, para isso, ser conservada em refrigerador. Não congele. Caso ocorra gravidez durante ou logo após o tratamento com CLAVULIN, suspenda a medicação e comunique imediatamente ao seu médico. CLAVULIN é contra-indicado a pacientes com história de reações alérgicas e hipersensibilidade às penicilinas. Comunique ao seu médico se estiver fazendo uso de outros medicamentos. O produto deve ser usado de acordo com a orientação dada pelo médico e somente ele poderá recomendar a sua interrupção. Caso surjam reações desagradáveis tais como diarréia, indigestão, náusea, vômito, urticária, procure orientação médica. A alimentação não interfere com a ação de CLAVULIN, podendo o mesmo ser ingerido juntamente com alimentos. A duração do tratamento depende do tipo e da gravidade da infecção. Siga corretamente a orientação do seu médico.
Informações técnicas.
CLAVULIN contém como princípios ativos a amoxicilina, quimicamente a D-(-)-alfa-amino p. hidroxibenzil penicilina, e o clavulanato de potássio, sal potássico do ácido clavulânico. CLAVULIN é um antibiótico de amplo espectro que possui a propriedade de atuar contra microrganismos Gram-positivos e Gram-negativos, produtores ou não de beta-lactamases. A amoxicilina é uma penicilina semi-sintética de amplo espectro de ação, derivada do núcleo básico da penicilina, o ácido 6-amino-penicilânico. O ácido clavulânico é uma substância produzida pela fermentação do Streptomyces clavuligerus, que possui a propriedade especial de inativar de modo irreversível as enzimas beta-lactamases, permitindo, desta forma, que os microrganismos se tornem sensíveis à rápida ação bactericida da amoxicilina. Ambos os sais possuem propriedades farmacocinéticas muito equivalentes: os seus níveis máximos ocorrem uma hora após a administração oral, têm baixa ligação protéica e podem ser administrados com as refeições, por serem estáveis em presença do ácido clorídrico do suco gástrico. Tanto a amoxicilina como o clavulanato de potássio são bem absorvidos tanto pela via entérica como pela parenteral. As concentrações séricas de amoxicilina alcançadas com o uso do CLAVULIN são similares àquelas produzidas pela administração de doses equivalentes de amoxicilina isoladamente. A meia-vida da amoxicilina após a administração de CLAVULIN é de 1,3 horas e a do ácido clavulânico é de 1,0 hora. Aproximadamente 50% a 70% de amoxicilina e 25% a 40% de ácido clavulânico são excretados sem modificações na urina durante as primeiras 6 horas após a administração de uma dose única de um comprimido de 500mg ou de 10ml de CLAVULIN suspensão oral 250mg. Nenhum dos componentes de CLAVULIN tem ligações protéicas em grande número; o ácido clavulânico apresenta um percentual de ligações protéicas de aproximadamente 30%, enquanto que a amoxicilina de 20%. A amoxicilina, como a maioria das penicilinas, pode ser detectada no leite materno. Com relação ao ácido clavulânico, não existem dados disponíveis a esse respeito. A amoxicilina se espalha rapidamente nos tecidos e fluidos do corpo, com exceção do cérebro e seu fluidos. Os resultados de experimentos envolvendo a administração do ácido clavulânico em animais sugere que esta substância, do mesmo modo que a amoxicilina, é bem distribuída pelos tecidos corporais. Duas horas após a administração de dose única de 35mg/kg de CLAVULIN suspensão oral a crianças em jejum, as concentrações médias de 3,0mcg/ml de amoxicilina e de 0,5mcg/ml de ácido clavulânico foram detectadas em efusões do ouvido médio. Cada comprimido revestido de CLAVULIN (500mg) contém 0,63mEq de potássio. Cada 5ml de suspensão oral reconstituída de CLAVULIN (250mg) contêm 0,32mEq de potássio. Cada 5ml de suspensão oral reconstituída de CLAVULIN (125mg) contêm 0,16mEq de potássio. A amoxicilina é um antibiótico semi-sintético com um largo espectro de atividade bactericida contra muitos microrganismos Gram-positivos e Gram-negativos. A amoxicilina é, todavia, suscetível à degradação por beta-lactamases e portanto o espectro de atividade não inclui organismos que produzem estas enzimas. O ácido clavulânico é um beta-lactâmico, estruturalmente relacionado às penicilinas, que possui a capacidade de inativar um gama de enzimas beta-lactamases comumente encontradas em microrganismos resistentes às penicilinas e às cefalosporinas. Em particular, tem boa atividade contra o plasmídeo mediador das beta-lactamases clinicamente importante para a transferência de resistência à droga. A formulação da amoxicilina com o ácido clavulânico no CLAVULIN protege a amoxicilina de degradação das enzimas beta-lactamases e estende de forma efetiva o espectro antibiótico da amoxicilina por incluir muitas bactérias normalmente resistentes à amoxicilina e outros antibióticos b-lactâmicos. Assim, o CLAVULIN possui a propriedade única de antibiótico de amplo espectro e inibidor de b-lactamase. CLAVULIN é bactericida para uma larga faixa de bactérias, incluindo: Bactérias Gram-positivas. Aeróbias: Staphylococcus aureus*, Staphylococcus coagulase negativo* (incluindo Staphylococcus epidermidis), Enterococcus faecalis, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus viridans, Corynebacterium spp., Bacillus anthracis, Listeria monocytogenes. Anaeróbias: Clostridium spp., Peptococcus spp., Peptostreptococcus spp. Bactérias Gram-negativas. Aeróbias: Haemophilus influenzae, Moraxella catarrhalis* (Branhamella catarrhalis), Escherichia coli*, Klebsiella spp.*, Proteus mirabilis*, Proteus vulgaris*, Neisseria gonorrhoeae*, Neisseria meningitidis, Salmonella spp.*, Shigella spp.*, Bordetella pertussis, Brucella spp., Vibrio cholerae, Pasteurella multocida. Anaeróbias: Bacteroides spp.* (incluindo o B. fragillis). * = Incluindo cepas produtoras de beta-lactamase, resistentes à ampicilina e amoxicilina. Informações adicionais: a resitência a muitos antibióticos é causada por enzimas baterianas que destroem o antibiótico antes que ele possa agir o patógeno. O clavulanato existente em CLAVULIN antecipa este mecanismo de defesa, bloqueado as enzimas b-lactamase, neutralizando, desta forma, os organismos sensíveis ao rápido efeito bactericida da amoxicilina em concentrações prontamente atingidas no corpo. O clavulanato isoladamente possui baixa atividade antibacteriana; entretanto, em associações com amoxicilina, como em CLAVULIN, ele produz uma agente antibiótico de amplo espectro com larga aplicação em hospitais e na clínica geral. A farmacocinética dos dois componentes de CLAVULIN é quase equivalente. O pico dos nívies séricos das duas substâncias ocorre cerca de 1 hora após a administração oral. A absroção de CLAVULIN é favorecida no início da refeição. tanto o clavulanato quanto a amoxicilina têm baixos níveis de ligação sérica; cerca de 70% permanecerem livres no soro. Duplicando-se a dosagem de CLAVULIN, aproximadamente duplicam-se os níveis séricos alcançados.
Indicações.
CLAVULIN é indicado no tratamento das infecções bacterianas causadas por germes sensíveis aos componentes da fórmula. CLAVULIN é bactericida para amplo gama de microrganismos, sendo efetivo nas seguintes condições: infecções do trato respiratório superior (incluindo ENT); ex.: amigdalite, sinusite, otite média. Infecções do trato respiratório inferior; ex.: bronquite aguda e crônica, pneumonia lobar e broncopneumonia. Infecções do trato geniturinário; ex.: cistite, uretrite, pielonefrites. Infecções da pele e dos tecidos moles. Infecções dos ossos e das articulações; ex.: osteomielite. Outras infecções; ex.: aborto séptico, sepse puerperal, sepse intra-abdominal. Embora CLAVULIN esteja indicado para os processos infecciosos referidos anteriormente, as infecções causadas por germes sensíveis à amoxilina (ampicilina) também podem ser tratadas com CLAVULIN, devido à presença da amoxicilina em sua fórmula. Assim, infecções mistas causadas por microrganismos sensíveis à ampicilina e microrganismos sensíveis à ampicilina e microrganismos produtores de beta-lactamases sensíveis a CLAVULIN, não devem exigir a adição de outro antibiótico.
Contraindicações.
CLAVULIN é contra-indicado a pacientes com história de reações alérgicas, hipersensibilidade às penicilinas, disfunção hepática/icterícia associadas a CLAVULIN ou a outras penicilinas. Deve ser dada atenção a possível sensibilidade cruzada com outros antibióticos beta-lactâmicos, exemplo: cefalosporinas.
Precauções.
Mudanças na função hepática foram observadas em alguns pacientes que estavam recebendo CLAVULIN. A importância clínica destas mudanças é incerta, mas CLAVULIN deve ser usado com cautela em pacientes com evidência de disfunção hepática grave. Icterícia colestática, que pode ser grave, mas geralmente reversível, foi raramente relatada. Os sinais e sintomas podem não ser aparentes por até 6 semanas após a interrupção do tratamento. A insuficiência renal não retarda a excreção nem do clavulanato nem da amoxicilina. Contudo, em pacientes com insuficiência renal moderada ou grave, a dose de CLAVULIN deve ser ajustada conforme recomendado em Dose. O clavulanato de potássio equivale a 125mg de ácido clavulânico e contém 0,63 mmol de potássio. Reações de hipersensibilidade (anafilactóides) sérias e ocasionalmente fatais têm sido relatadas em pacientes recebendo tratamento com derivados penicilânicos. Embora a anafilaxia seja mais freqüente após tratamento parenteral, pode também ocorrer em pacientes recebendo tratamento oral. Estas reações são mais passíveis de ocorrerem em indivíduos com história de hipersensibilidade à penicilina e/ou história de sensibilidade a múltiplos alérgenos. Têm sido relatados casos de pacientes com história de hipersensibilidade à penicilina e que tiveram graves reações quando tratados com cefalosporinas. Antes de iniciar um tratamento com um derivado penicilânico, deve ser realizada uma criteriosa e minuciosa pesquisa do passado alérgico do paciente quanto a reações às penicilinas, cefalosporinas ou a outros alérgenos. Caso ocorra uma reação alérgica, CLAVULIN deve ser imediatamente descontinuado e terapêutica adequada deve ser instituída. Reações anafilactóides graves requerem tratamento de emergência com epinefrina. Oxigênio esteróides intravenosos e assistência respiratória, inclusive intubação pode ser instituída, se indicada. Embora CLAVULIN possua a característica de baixa toxicidade do grupo de antibióticos penicilânicos, um acompanhamento periódico das funções orgânicas, incluindo funções renal, hepática e hematopoiética, é recomendado durante tratamento prolongado. O uso prolongado também ocasionalmente resultar em crescimento excessivo de organismos não-susceptíveis. Um grande número de pacientes com mononucleose que recebem ampicilina desenvolve rash cutâneo. Então, os antibióticos desta classe não devem ser administrados a pacientes jcom mononucleose. A possibilidade de superinfecções por fungos ou bactérias deve ser considerada durante o tratamento. Se a superinfecção ocorrer (usualmente envolvendo Pseudomonas ou Candida), a droga deve ser descontinuada e/ou a terapia apropriada instituída. Estudos de reprodução em animais (camundongos e ratos) com CLAVULIN administrado por via oral e parenteral não demonstraram efeitos teratogênicos. A experiência com o uso de CLAVULIN durante a gravidez é limitada. Da mesma forma que com todos os medicamentos, deve-se evitar o uso de CLAVULIN na gravidez, especialmente durante o primeiro trimestre, a menos que seja considerado essencial pelo médico. CLAVULIN pode ser administrado durante o período de lactação. Com exceção do risco de sensibilização, associado à excreção de pequenas quantidades no leite materno, não existem efeitos nocivos para a criança.
Interações medicamentosas.
A probenecida retarda a excreção renal da amoxicilina. O seu uso concomitante com CLAVULIN pode resultar em um aumento do nível de amoxicilina no sangue, mas não o do ácido clavulânico; portanto, não é recomendado. A administração concomitante de alopurinol e ampicilina aumenta consideravelmente a incidência de rash em pacientes recebendo ambas as drogas se comparados a pacientes recebendo somente ampicilina. Não se sabe se esta potencialização do efeito da ampicilina é devido ao alopurinol ou à hiperuricemia presente nestes pacientes. Não há dados sobre a administração concomitante de CLAVULIN e alopurinol. A ingestão de álcool deve ser evitada durante e por vários dias após o tratamento com CLAVULIN. CLAVULIN não deve ser administrado junto com dissulfiram. O prolongamento dos tempos de sangramento e de protrombina foram relatados em alguns pacientes que estavam recebendo CLAVULIN. CLAVULIN deve ser usado com cautela em pacientes sob tratamento com anticoagulantes. Da mesma forma que outros antibióticos de amplo espectro, CLAVULIN pode reduzir a eficácia dos contraceptivos orais. As pacientes devem ser avisadas quanto a este fato.
Posologia e modo de usar.
Posologia para o tratamento da infecção <196> Adultos e crianças acima de 12 anos: 1 comprimido revestido de 500mg, 3 vezes/dia. Crianças menores de 1 ano: 2,5ml de suspensão oral a 125mg/5ml, 3 vezes/dia* (* = A dose diária usual recomendada é de 25mg/kg/dia em doses divididas de 8 em 8 horas). Crianças de 1-6 anos (10-18kg): 5ml de suspensão oral a 125mg/5ml, 3 vezes/dia. Crianças acima de 6 anos (18-40kg): 5ml da suspensão a 250mg/5ml, 3 vezes/dia. A dose deve ser aumentada, a critério médico, nos casos de infecções graves até 50mg/kg/dia em doses divididas de 8 em 8 horas. Cada 25mg de CLAVULIN fornece 20mg de amoxicilina e 5mg de ácido clavulânico. Os comprimidos de CLAVULIN não são recomendados para crianças menores de 12 anos de idade. Dose para insuficiência renal <196> Adultos. Insuficiência leve (clearance de creatinina > 30ml/min): sem alterações na dose. Insuficiência moderada (clearance de creatinina 10-30ml/min): um comprimido de 500mg a cada 12 horas. Insuficiência grave (clearance de creatinina < 10ml/min): os comprimidos de 500mg não são recomendados. Crianças. Reduções similares na dose devem ser feitas para crianças. Dose para insuficiência hepática: a dose deve ser feita com cautela; monitore a função hepática em intervalos regulares. A dose deve ser aumentada, de acordo com as instruções do médico, em casos de infecções graves. Para crianças pesando 40kg ou mais, deve ser administrada a dose de adulto. Para preparar a suspensão, coloque água filtrada até a marca indicada no rótulo e agite bem o frasco até que o pó se misture totalmente com água. Verifique se a mistura atingiu a marca. Agite a suspensão antes de usar. Para minimizar a intolerância gastrintestinal potencial, administrar o medicamento no início da refeição. A absorção de CLAVULIN é favorecida quando o medicamento é administrado no início da refeição. O tratamento não deve ser estendido por mais de 14 dias sem revisão.
Reações adversas.
CLAVULIN é geralmente bem tolerado. A maioria das reações adversas observadas em estudos clínicos são de natureza transitória e leve e menos de 3% dos pacientes descontinuaram o tratamento em função dessas reações, decorrentes do uso do medicamento. As mais freqüentes reações relatadas foram: diarréia, colite pseudomembranosa, candidíase, indigestão, náusea, vômitos, rash cutâneo, urticária e vaginite. A náusea, apesar de rara, é mais freqüentemente associada a altas doses por via oral. Caso ocorram efeitos colaterais gastrintestinais com o tratamento oral, eles podem ser reduzidos com a ingestão de CLAVULIN no início das refeições.Da mesma forma que com outros antibióticos, a incidência de efeitos colaterais gastrintestinais pode aumentar em crianças com menos de 2 anos. Entretanto em pesquisas clínicas, apenas 4% das crianças com menos de 2 anos foram retiradas do tratamento. A incidência de reações adversas, particularmente diarréia, aumentou em função do aumento da dose recomendada do CLAVULIN. Outras reações relatadas com menos freqüência incluem desconforto abdominal, flatulência e cefaléia. As seguintes reações adversas tem sido relatadas com o uso de antibióticos penicilânicos: gastrintestinais: diarréia, náusea, vômito, indigestão, gastrite, estomatite, glossite, enterocolite, colite pseudomembranosa, língua saburrosa e candidíase intestinal. Colite associada ao antibiótico (incluindo colite pseudomembranosa e colite hemorrágica) têm sido raramente relatadas. Reações de hipersensibilidade: edema angioneurótico, analifaxia, síndrome semelhante a doença do soro (urticária ou rash cutâneo acompanhado de artrite, artralgia, mialgia freqüentemente febre), vasculite de hipersensibilidade. Rash eritematoso e urticária ocorrem algumas vezes. Raramente eritema multiforme, síndrome de Stevens-Johnson, necrólise epidérmica tóxica e dermatite exfoliativa têm sido relatadas. O tratamento deve ser descontinuado se ocorrer uma dessas reações. Estas reações podem ser controladas com anti-histamínicos e, se necessário, corticosteróides sistêmicos. Rashes eritematosos têm sido associados à febre glandulark em pacientes recebendo amoxicilina. CLAVULIN deve ser evitado se existir suspeita de febre glandular. Nefrite intersticial pode ocorrer raramente. Hepáticas: um aumento moderado no SGOT, SGPT, TGO e/ou TGA foi detactado em pacientes tratados com esta classe de antibióticos, inluindo o CLAVULIN. A significância desses achados é desconhecida, da mesma forma que com outras pnicilinas e cefalosporinas, disfunções hepáticas raramente têm sido relatadas, com a predominância de efeitos colestácio e hepatocelular ou ambos. Estes sinais/sintomas podem aparecer durante ou após o tratamento, e desaparecer completamente após a interrupção da medicação. Hepatite e icterícia colestática raramente foram relatadas com CLAVULIN. Entretanto, podem ser graves e continuar por vários meses. Têm ocorrido predominantemente em adultos ou idosos, e com freqüência ligeiramente maior em homens. Os sinais e sintomas podem ocorrer durante o tratamento, mas são mais freqüentemente relatados após o término do tratamento, com uma demora de até seis semanas. Os eventos hepáticos são geralmente reversíveis, entretanto, em circunstâncias extremamente raras, houve relatos de morte. Eventos hepáticos têm sido relatados predominantemente em homens e pacientes idosos, e podem ser associados ao tratamento prolongado, e quase sempre foram associados a doençãs latentes graves ou medicações concomitantes. Sistema hematológico: trombocitopenia reversível e anemia hemolítica, púrpura trombocitopênica, eosinofilia, leucopenia reversível (incluindo neutropenia ou agranulocitose) raramente foram relatadas. Estas reações são normalmente reversíveis com a interrupção do tratamento e são tidas como fenômenos de hipersensibilidade. Uma branda trombocitose foi verificada em menos de 1% dos pacientes tratados com CLAVULIN. Sistema Nervoso Central: hiperatividade reversível, agitação, ansiedade, insônia, confusão mental, modificações no comportamente e/ou vertigem, cefaléia e convulsões foram raramente relatadas. As convulsões podem ocorrer em pacientes com função renal comprometida ou naqueles recebendo altas dosagens.
Superdose.
É pouco provável que, em caso de superdose de CLAVULIN, ocorram problemas. . Se aparecerem, sintomas gastrintestinais e distúrbios no balanço hidroeletrolítico poderão ser evidentes. Nestes casos, o tratamento é sintomático. A amoxicilina pode ser removida da circulação por hemodiálise. O peso molecular, o grau de ligação protéica e o perfil farmacocinético do ácido clavulânico, em conjunto com informações de um paciente com insuficiência renal, sugerem que este componente também pode ser removido por hemodiálise.
CLAVULIN
GLAXOSMITHKLINE
Comprimidos revestidos
amoxicilina + clavulânico, ácido
Antibiótico.
Apresentações.
Comprimido revestido: embalagens com 21 e 30 unidades de 500 mg + 125 mg
USO ORAL USO ADULTO E PEDIÁTRICO (ACIMA DE 12 ANOS)
Composição.
Cada comprimido revestido contém: amoxicilina (na forma de amoxicilina triidratada) 500 mg, ácido clavulânico (na forma de clavulanato de potássio) 125 mg excipientes* q.s.p. 1 comprimido
* Excipientes: estearato de magnésio, amidoglicolato de sódio, sílica coloidal anidra, celulose microcristalina, dióxido de titânio, hipromelose, polietilenoglicol, dimeticona.
Indicações.
Clavulin®, deve ser utilizado de acordo com as diretrizes locais para prescrição de antibióticos e dados de sensibilidade.
Clavulin® é indicado para tratamento das infecções bacterianas causadas por germes sensíveis aos componentes da fórmula. Clavulin®, bactericida que atua contra ampla gama de microrganismos, é efetivo nas seguintes condições:
- infecções do trato respiratório superior (inclusive ouvido, nariz e garganta), como amigdalite, sinusite e otite média;
- infecções do trato respiratório inferior, como bronquite aguda e crônica, pneumonia lobar e broncopneumonia;
- infecções do trato geniturinário, como cistite, uretrite e pielonefrites;
- infecções de pele e tecidos moles, como furúnculos, abscessos, celulite e ferimentos infectados;
- infecções de ossos e articulações, como osteomielite;
- outras infecções, como aborto séptico, sepse puerperal e sepse intra-abdominal.
A sensibilidade ao Clavulin® irá variar com a região e com o tempo. Sempre que disponíveis, dados de sensibilidade locais devem ser consultados. Sempre que necessário, amostragem microbiológica e testes de sensibilidade devem ser realizados.
Embora Clavulin® seja indicado apenas para os processos infecciosos referidos anteriormente, as infecções causadas por germes sensíveis à amoxicilina (ampicilina) também podem ser tratadas com Clavulin®, devido à presença da amoxicilina em sua fórmula. Assim, as infecções mistas causadas por microrganismos sensíveis à amoxicilina e por microrganismos produtores de betalactamases sensíveis a Clavulin® não devem exigir a adição de outro antibiótico.
Resultados de eficácia.
Dados recentes indicam que as taxas de sucesso clínico para a amoxicilina /clavulanato no tratamento da infecção do trato respiratório e otite média aguda (OMA) são mantidas ~ 90%. A amoxicilina / clavulanato, é portanto, um tratamento de grande valia para as infecções do trato respiratório, em especial porque o médico muitas vezes não é capaz de determinar o patógeno causador subjacente, e nestes casos faz-se necessária a terapia empírica.(White AR, Kaye C, et al. Augmentin® (amoxicillin/clavulanate) in the treatment of community-acquired respiratory tract infection: a review of the continuing development of an innovative antimicrobial agent. Journal of Antimicrobial Chemotherapy (2004) 53, Suppl. S1, i3-i20).
Em um estudo duplo-cego envolvendo 324 pacientes com evidência clínica de pneumonia adquirida na comunidade (PAC) ou uma exacerbação aguda da bronquite crônica, que foram randomizados para receber tratamento de 10 dias com amoxicilina / clavulanato 875/125 mg duas vezes ao dia ou amoxicilina / ácido clavulânico 500/125 mg três vezes ao dia. No final da terapia, as taxas de sucesso clínico foram de 92,4% para o regime de duas vezes por dia e 94,2% para o de três vezes ao dia. (Balgos AA, Rodriguez-Gomez G, et al. Efficacy of twice-daily amoxycillin/clavulanate in lower respiratory tract infections. Int J Clin Pract. 1999; 53(5):325-30.)
Caract. farmacológicas.
Propriedades farmacodinâmicas
Código ATC J01CR02
Mecanismo de ação
Clavulin® é um antibiótico de amplo espectro que possui a propriedade de atuar contra microrganismos gram-positivos e gram-negativos, produtores ou não de betalactamases.
A amoxicilina é uma penicilina semissintética com amplo espectro de ação e deriva do núcleo básico da penicilina, o ácido 6aminopenicilânico. O ácido clavulânico é uma substância produzida pela fermentação do Streptomyces clavuligerus, que possui a propriedade especial de inativar de modo irreversível as enzimas betalactamases, permitindo, dessa forma, que os microrganismos se tornem sensíveis à rápida ação bactericida da amoxicilina. Ambos os sais possuem propriedades farmacocinéticas muito equivalentes: os níveis máximos ocorrem 1 hora após a administração oral, têm baixa ligação proteica e podem ser administrados com as refeições porque permanecem estáveis na presença do ácido clorídrico do suco gástrico.
Clavulin® contém como princípios ativos a amoxicilina, quimicamente D-(-)-alfa-amino-p-hidroxibenzilpenicilina, e o clavulanato de potássio, sal potássico do ácido clavulânico.
O ácido clavulânico é um betalactâmico estruturalmente relacionado às penicilinas que possui a capacidade de inativar uma gama de enzimas betalactamases comumente encontradas em microrganismos resistentes às penicilinas e às cefalosporinas. Tem, em particular, boa atividade contra o plasmídeo mediador das betalactamases, clinicamente importante para a transferência de resistência à droga.
A formulação da amoxicilina com o ácido clavulânico em Clavulin® protege a amoxicilina da degradação das enzimas betalactamases e estende de forma efetiva o espectro antibiótico desse fármaco por abranger muitas bactérias normalmente resistentes a esse e a outros antibióticos betalactâmicos. Assim, Clavulin® possui a propriedade única de antibiótico de amplo espectro e de inibidor de betalactamases.
A amoxicilina é um antibiótico com largo espectro de atividade bactericida contra muitos microrganismos gram-positivos e gram-negativos. É, todavia, suscetível à degradação por betalactamases; portanto, seu espectro de atividade não inclui os organismos que produzem essas enzimas.
Efeitos Farmacodinâmicos
Na lista abaixo, os microrganismos foram categorizados de acordo com a sensibilidade in vitro a amoxicilina/ clavulanato.
Espécies comumente sensíveis
Bactérias gram-positivas:
-aeróbias - Staphylococcus aureus (sensível a meticilina)*, Staphylococcus saprophyticus (sensível a meticilina), Staphylococcus coagulase-negativo (sensível a meticilina), Enterococcus faecalis, Streptococcus pyogenes*† , Bacillus anthracis, Listeria monocytogenes, Nocardia asteroides, Streptococcus agalactiae*†, Streptococcus spp. (outros b-hemolíticos)*† .
-anaeróbias - Clostridium sp., Peptococcus niger, Peptostreptococcus magnus, Peptostreptococcus micros, Peptostreptococcus spp.
Bactérias gram-negativas:
-aeróbias - Bordetella pertussis, Haemophilus influenzae*, Haemophilus parainfluenzae, Helicobacter pylori, Moraxella catarrhalis, Neisseria gonorrhoeae, Vibrio cholerae, Pasteurella multocida.
-anaeróbias - Bacteroides spp. (inclusive B. fragilis), Capnocytophaga spp., Eikenella corrodens, Fusobacterium spp. (inclusive F. nucleatum), Porphyromonas spp. Prevotella spp.
Outras: Borrelia burgdorferi, Leptospira ictterohaemorrhagiae, Treponema pallidum.
Espécies que a resistência adquirida pode se tornar um problema
Bactérias gram-negativas:
Aeróbias: Escherichia coli*, Klebsiella oxytoca, Klebsiella pneumoniae*, Klebsiella spp., Proteus mirabilis, Proteus vulgaris, Proteus spp., Salmonella spp., Shigella spp.
Bactérias gram-positivas:
Aeróbias: Corynebacterium sp., Enterococcus faecium, Streptococcus pneumoniae*†, Streptococcus do grupo Viridans.
Organismos inerentemente resistentes
Bactérias gram-negativas:
Aeróbias: Acinetobacter spp., Citrobacter freundii, Enterobacter spp., Hafnia alvei, Legionella pneumophila, Morganella morganii, Providencia spp., Pseudomonas spp., Serratia spp., Stenotrophomas maltophilia, Yersinia enterolitica
Outras: Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia spp., Coxiella burnetti, Mycoplasma spp.
* a eficácia clínica de amoxilicina-ácido clavulânico foi demonstrada em estudos clínicos
† microrganismos que não produzem beta-lactamase. Se um microrganismo isolado é sensível a amoxicilina, pode ser considerado sensível a Clavulin® .
Propriedades farmacocinéticas
Absorção
Os dois componentes, de amoxicilina-clavulanato, amoxicilina e ácido clavulânico são totalmente dissociados em solução aquosa em pH fisiológico. Ambos os componentes são rapidamente e bem absorvidos por administração via oral. Absorção de amoxicilina-clavulanato é otimizada quando tomado no início de uma refeição.
As concentrações séricas da amoxicilina alcançadas com o uso de Clavulin® são similares às produzidas pela administração de dosagens equivalentes e isoladas desse fármaco. A meia-vida da amoxicilina após a administração de Clavulin® é de 1,3 hora e a do ácido clavulânico de 1,0 hora.
São apresentados na tabela abaixo, os resultados farmacocinéticos de dois estudos separados, em que a amoxicilina-clavulanato 250/125 (375) ou 2 x 250/125 e 500/125 (625) mg em comprimidos (em comparação com os dois ativos dados separadamente) foram administrados em jejum.
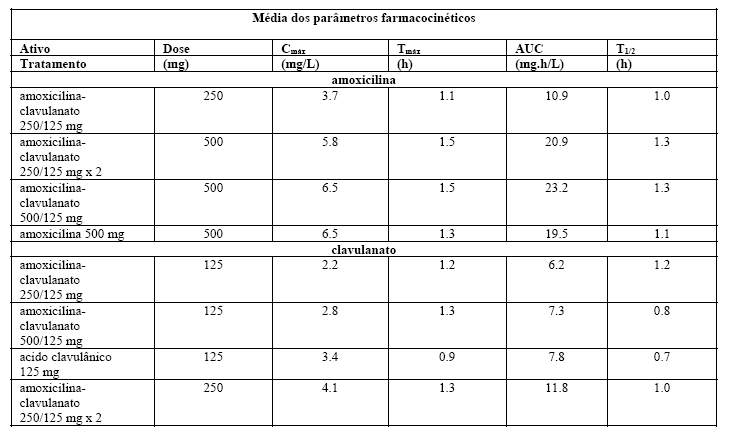
As concentrações séricas de amoxicilina obtidas com amoxicilina-clavulanato são semelhantes àquelas produzidas pela administração oral de doses equivalentes de amoxicilina isolada.
Distribuição
Estudos de reprodução em animais demonstraram que tanto a amoxicilina quanto o ácido clavulânico penetram na barreira placentária. No entanto, não foi detectada nenhuma evidência de diminuição da fertilidade ou dano ao feto.
Nenhum dos componentes de Clavulin® apresenta forte ligação protéica; o percentual de ligação protéica do ácido clavulânico é de aproximadamente 25%, enquanto o da amoxicilina é de 18%.
A amoxicilina, como a maioria das penicilinas, pode ser detectada no leite materno. Com relação ao ácido clavulânico, não existem dados disponíveis a esse respeito Traços de clavulanato também podem ser detectados. Com exceção do risco de sensibilização associado a esta excreção, não são conhecidos efeitos nocivos ao lactente.
Os estudos de reprodução em animais demonstraram que tanto a amoxicilina quanto o ácido clavulânico penetram na barreira placentária. No entanto, nenhuma evidência de diminuição da fertilidade ou dano ao feto foi detectado.
Não há evidências em estudos animais que os componentes do Clavulin® se acumulam em algum órgão.
A amoxicilina distribui-se rapidamente nos tecidos e fluidos do corpo, mas não no cérebro e seus fluidos. Os resultados de experimentos que envolveram a administração do ácido clavulânico em animais sugerem que essa substância, do mesmo modo que a amoxicilina, é bem distribuída pelos tecidos corporais.
Metabolismo
A amoxicilina é parcialmente excretada na urina na forma de ácido penicilóico em quantidades equivalentes a 10- 25% da dose inicial. O ácido clavulânico é amplamente metabolizado em 2,5 - diidro-4-(2-hidroxietil)-5-oxo-1H-pirrol-3 ácido carboxílico e 1-amino-4-hidroxi-butan-2-ona sendo eliminado na urina e fezes.
Eliminação
Como com outras penicilinas, a principal via de eliminação da amoxicilina é através dos rins, enquanto que para clavulanato os mecanismos de eliminação são renal e não-renal.
Aproximadamente 60% a 70% de amoxicilina e 40% a 65% de ácido clavulânico são excretados sem modificações na urina durante as primeiras 6 horas após a administração de dose única de um comprimido de 500 mg ou de 10 mL de suspensão oral de 250 mg de Clavulin® .
O uso concomitante de probenecida retarda a excreção de amoxicilina, mas não a excreção renal de ácido clavulânico (ver Interações Medicamentosas).
Contraindicações.
Clavulin® é contraindicado para pacientes com história de reações alérgicas, hipersensibilidade a penicilinas e disfunção hepática/icterícia associadas a este medicamento ou a outras penicilinas.
Deve-se dar atenção à possível sensibilidade cruzada com outros antibióticos betalactâmicos, como as cefalosporinas.
Advertências e precauções.
Antes de iniciar o tratamento com Clavulin®, deve-se fazer uma pesquisa cuidadosa sobre as reações prévias de hipersensibilidade a penicilinas e cefalosporinas ou a outros alérgenos.
Há relatos de reações de hipersensibilidade (anafilactoides) graves e ocasionalmente fatais em pacientes que recebem tratamento com derivados penicilânicos (ver Contraindicações). Essas reações ocorrem, mais provavelmente, em indivíduos com história de hipersensibilidade à penicilina e/ou a múltiplos alérgenos. Caso haja reação alérgica, recomenda-se descontinuar imediatamente o uso de Clavulin® e instituir uma terapia adequada. As reações anafilactoides graves requerem tratamento de emergência com epinefrina. Se necessário, pode-se também instituir oxigênio, esteroides intravenosos e assistência respiratória, inclusive entubação.
Deve-se evitar o uso de Clavulin® em pacientes sob suspeita de mononucleose, uma vez que a ocorrência de rash cutâneo de aspecto morbiliforme tem sido associada à amoxicilina.
O uso prolongado também pode, ocasionalmente, resultar em crescimento excessivo de organismos não sensíveis.
Foi relatada colite pseudomembranosa com o uso de antibióticos, que pode ter gravidade variada entre leve e risco à vida. Portanto, é importante considerar o diagnóstico de doentes que desenvolvam diarreia durante ou após o uso de antibióticos. Se ocorrer diarreia prolongada ou significativa, ou o paciente sentir cólicas abdominais, o tratamento deve ser interrompido imediatamente e a condição do paciente investigada.
Houve relatos raros de prolongamento anormal do tempo de protrombina (aumento da razão normalizada internacional, INR) em alguns pacientes que receberam tratamento com Clavulin® e anticoagulantes orais. Deve-se fazer o monitoramento apropriado quando anticoagulantes forem prescritos para uso concomitante.
Podem ser necessários ajustes de dose de anticoagulantes orais para manter o nível desejado de anticoagulação.
Observaram-se mudanças da função hepática em alguns pacientes sob tratamento com Clavulin®. A importância clínica dessas mudanças é incerta, mas Clavulin® deve ser usado com cautela em pacientes que apresentam evidência de disfunção hepática.
Houve relatos raros de icterícia colestática, que pode ser grave, mas geralmente é reversível. Os sinais e sintomas talvez não se manifestem no período de até seis semanas após a interrupção do tratamento.
Para os pacientes com disfunção renal, deve-se ajustar a dosagem (ver Posologia e Modo de Usar).
Nos pacientes que apresentaram redução do volume de produção de urina, muito raramente se observou cristalúria, que ocorreu sobretudo com terapia parenteral. Durante a administração de altas doses de Clavulin®, deve-se manter ingestão adequada de líquidos, assim como eliminação normal de urina, a fim de minimizar a possibilidade de cristalúria.
A insuficiência renal não retarda a excreção do clavulanato de potássio nem da amoxicilina. Contudo, para os pacientes com insuficiência renal moderada ou grave, deve-se ajustar a dose de Clavulin® (ver Posologia e Modo de Usar).
Embora Clavulin® tenha a característica de baixa toxicidade do grupo dos antibióticos penicilânicos, recomenda-se, durante tratamentos prolongados, o acompanhamento periódico das funções orgânicas, inclusive renais, hepáticas e hematopoiéticas.
Deve-se considerar a possibilidade de superinfecções por fungos ou bactérias durante o tratamento. Se ocorrer superinfecção (que usualmente envolve Pseudomonas ou Candida), recomenda-se descontinuar a droga e/ou instituir terapia apropriada.
Efeitos sobre a capacidade de dirigir veículos e de operar máquinas
Não se observaram efeitos sobre a capacidade de dirigir veículos e de operar máquinas.
Gravidez e lactação
Gravidez Estudos sobre reprodução em animais (camundongos e ratos) nos quais Clavulin® foi administrado por via oral e parenteral não demonstraram efeitos teratogênicos. Em um único estudo, feito com mulheres que haviam tido parto prematuro com ruptura precoce da bolsa amniótica, relatou-se que o uso profilático de Clavulin® pode estar associado ao aumento do risco de o neonato apresentar enterocolite necrotizante. Como ocorre com todos os medicamentos, deve-se evitar o uso de Clavulin® na gravidez, especialmente durante o primeiro trimestre, a menos que o médico o considere essencial.
Lactação
Clavulin® pode ser administrado durante o período de lactação. Com exceção do risco de sensibilidade associado à excreção de pequenas quantidades da droga no leite materno, não existem efeitos nocivos para a criança.
Categoria B de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações medicamentosas.
A probenecida retarda a excreção renal da amoxicilina. Seu uso concomitante com o de Clavulin® pode resultar em aumento e prolongamento do nível de amoxicilina no sangue, mas não de ácido clavulânico, não sendo, portanto, recomendável.
A administração concomitante de alopurinol e amoxicilina aumenta consideravelmente a incidência de rash em comparação ao uso isolado de amoxicilina. Não se sabe se essa potencialização do efeito da amoxicilina se deve ao alopurinol ou à hiperuricemia presente nesses casos. Não há dados sobre a administração concomitante de Clavulin® e alopurinol. Da mesma forma que outros antibióticos, Clavulin® pode afetar a flora intestinal e assim reduzir a reabsorção de estrógenos. Com isso, se Clavulin® é usado em combinação com contraceptivos orais, estes podem ter sua efi
cácia reduzida.
A ingestão de álcool deve ser evitada durante e vários dias após o tratamento com Clavulin® . Clavulin® não deve ser administrado junto com dissulfiram.
Relatou-se prolongamento do tempo de sangramento e do tempo de protrombina em alguns pacientes tratados com Clavulin®. Assim, este medicamento deve ser usado com cautela nos pacientes sob tratamento com anticoagulantes.
Há, na literatura, raros casos de aumento da INR em pacientes em uso de acenocumarol ou varfarina que recebem um ciclo de tratamento com amoxicilina. Se a coadministração for necessária, o tempo de protrombina e a INR devem ser cuidadosamente monitorados com o início ou interrupção da terapia com Clavulin® .
Em pacientes que receberam micofenolato de mofetila, foi relatada uma redução na concentração do metabólito ativo ácido micofenólico de cerca de 50% após o início do uso de amoxicilina + ácido clavulânico por via oral. A mudança no nível pré-dose pode não representar com precisão alterações na exposição geral ao MPA.
Cuidados de armazenamento.
Cuidados de conservação
Conserve o produto ao abrigo da umidade e em temperatura ambiente (entre 15°C e 30°C). O prazo de validade é de 24 meses a partir da data de fabricação, impressa na embalagem do produto.
Apenas remova o envelope para o uso do produto. Os comprimidos devem ser utilizados em até 14 dias após a abertura do envelope.
Número de lote e datas de fabricação e validade: vide embalagem. Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto físico/características organolépticas
Comprimido oval, biconvexo, com revestimento de cor branca, que pode ser gravado.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Posologia e modo de usar.
Modo de usar
Para minimizar a potencial intolerância gastrintestinal, recomenda-se administrar o medicamento no início da refeição. Essa forma de administração favorece a absorção de Clavulin® .
O tratamento não deve ser estendido por mais de 14 dias sem revisão.

Os comprimidos de Clavulin® não são recomendados para crianças menores de 12 anos.
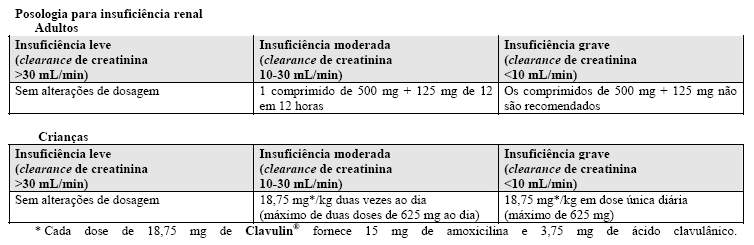
Posologia para insuficiência hepática
O tratamento deve ser cauteloso; monitore a função hepática em intervalos regulares.
Em casos de infecção grave, deve-se aumentar a posologia.
No caso de crianças que pesam 40 kg ou mais, deve-se aplicar a posologia para adultos.
Este medicamento não deve ser partido, aberto ou mastigado.
Reações adversas.
Usaram-se dados de estudos clínicos feitos com grande número de pacientes para determinar a frequência das reações indesejáveis (de muito comuns a raras). A frequência de todas as outras reações indesejáveis (isto é, aquelas que ocorreram em nível menor que 1/10.000) foi determinada utilizando-se principalmente dados de pós-comercialização e se refere à taxa de relatos, e não à frequência real.
Utilizou-se a seguinte convenção na classificação da frequência das reações: muito comuns ( > 1/10), comuns ( > 1/100 e < 1/10), incomuns ( > 1/1.000 e < 1/100), raras ( > 1/10.000 e < 1/1.000) e muito raras ( < 1/10.000).
Reações muito comuns ( > 1/10): diarreia (em adultos)
Reações comuns ( > 1/100 e < 1/10)
-candidíase mucocutânea
-náusea e vômitos (em adultos)*
-diarreia, náusea e vômitos (em crianças)*
-vaginite
Reações incomuns ( > 1/1.000 e < 1/100)
-tontura
-dor de cabeça
-indigestão
-aumento moderado de AST e/ou ALT em pacientes tratados com antibióticos betalactâmicos, mas o significado desse achado ainda é desconhecido**
-rash, prurido e urticária
Reações raras ( > 1/10.000 e < 1/1.000)
-leucopenia reversível (inclusive neutropenia) e trombocitopenia
-eritema multiforme
Reações muito raras ( < 1/10.000)
-agranulocitose reversível e anemia hemolítica, prolongamento do tempo de sangramento e do tempo de protrombina
-edema angioneurótico, anafilaxia, síndrome semelhante à doença do soro e vasculite de hipersensibilidade
-hiperatividade reversível e convulsões (estas podem ocorrer em pacientes com função renal reduzida ou naqueles que tomam altas doses)
-colite associada a antibióticos (entre elas, colite pseudomembranosa e hemorrágica) (ver Advertências e Precauções)
-língua pilosa negra
-hepatite e icterícia colestática (esses eventos foram observados também com outros penicilínicos e cefalosporínicos)**
-síndrome de Stevens-Johnson, necrólise epidérmica tóxica, dermatite exfoliativa bolhosa e exantema pustuloso generalizado agudo
-nefrite intersticial e cristalúria
Outras reações adversas
-trombocitopenia e púrpura
-ansiedade, insônia e confusão mental (relatos raros)
-glossite
Se ocorrer qualquer reação dermatológica de hipersensibilidade, o tratamento deve ser descontinuado.
* A náusea está comumente associada a altas dosagens orais. Caso reações gastrintestinais se tornem evidentes, é possível minimizá-las administrando-se a dose do produto no início das refeições.
** Houve relatos de eventos hepáticos, predominantemente em homens e idosos, que podem estar associados a tratamentos prolongados. São muito raros os relatos desses eventos em crianças.
Crianças e adultos: alguns sinais e sintomas usualmente ocorrem durante o tratamento ou logo após, mas em certos casos podem não se tornar aparentes até várias semanas depois do término da terapia. São normalmente reversíveis. Os eventos hepáticos podem ser graves; em circunstâncias extremamente raras, houve relatos de mortes. Estas ocorreram quase sempre entre pacientes com doença subjacente grave ou que faziam uso de outros medicamentos com conhecido potencial para provocar efeitos hepáticos indesejáveis.
Em casos de eventos adversos, notifique o Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou a Vigilância Sanitária Estadual ou Municipal.
Superdose.
É pouco provável que ocorram problemas causados por superdosagem de Clavulin®. Caso sintomas gastrintestinais e distúrbios do balanço hidreletrolítico se tornem evidentes, deve-se instituir tratamento sintomático.
A amoxicilina pode ser removida da circulação por hemodiálise. O peso molecular, o grau de ligação proteica e o perfil farmacocinético do ácido clavulânico, em conjunto com informações sobre um paciente com insuficiência renal, sugerem que essa droga também pode ser removida por hemodiálise.
Observou-se cristalúria causada pelo uso de amoxicilina, que em alguns casos levou à falência renal (ver Advertências e Precauções).
Em caso de intoxicação ligue para 0800 722 6001 se você precisar de mais orientações.
INFORMAÇÕES ADICIONAIS
A resistência a muitos dos antibióticos é causada por enzimas bacterianas que os destroem antes que eles possam agir sobre o patógeno. O clavulanato existente em Clavulin® antecipa esse mecanismo de defesa bloqueando as enzimas betalactamases e, dessa forma, neutralizando os organismos sensíveis ao rápido efeito bactericida da amoxicilina em concentrações prontamente atingidas no corpo. Usado isoladamente, o clavulanato apresenta baixa atividade antibacteriana; entretanto, em associação com a amoxicilina, como em Clavulin®, torna-se um agente antibiótico de amplo espectro e de larga aplicação em hospitais e na clínica geral.
A farmacocinética dos dois componentes de Clavulin® é quase equivalente. O pico dos níveis séricos das duas substâncias ocorre cerca de 1 hora após a administração oral. A absorção de Clavulin® é favorecida no início da refeição. Tanto o clavulanato quanto a amoxicilina têm baixos níveis de ligação sérica; cerca de 70% permanecem livres no soro. A duplicação da dosagem de Clavulin® pode aumentar os níveis séricos a valores proporcionalmente mais altos.
Dizeres legais.
M.S. 1.0107.0076
VENDA SOB PRESCRIÇÃO MÉDICA.
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Esta bula foi aprovada pela Anvisa em 30/10/2013.
CLAVULIN
GLAXOSMITHKLINE
Injetável
amoxicilina + clavulânico, ácido
Antibiótico.
Apresentações.
Pó liófilo injetável. Apresentado em embalagens com 10 frascos-ampola de 500 mg + 100 mg ou de 1 g + 200 mg.
USO ADULTO E PEDIÁTRICO
USO INTRAVENOSO
Composição.
Cada frasco-ampola de 500 mg + 100 mg contém: amoxicilina (na forma sódica) 500 mg, ácido clavulânico (na forma de clavulanato de potássio) 100 mg.
Cada frasco-ampola de 1 g + 200 mg contém: amoxicilina (na forma sódica) 1.000 mg, ácido clavulânico (na forma de clavulanato de potássio).200 mg.
Indicações.
Clavulin® IV deve ser utilizado de acordo com os guias locais para prescrição de antibióticos e dados de sensibilidade.
Clavulin® IV é indicado para tratamentos de curta duração de infecções bacterianas dos seguintes sítios:
- infecções do trato respiratório superior (inclusive ouvido, nariz e garganta), como amigdalite, sinusite e otite média;
- infecções do trato respiratório inferior, como bronquite aguda e crônica, pneumonia lobar e broncopneumonia;
- infecções do trato geniturinário, como cistite, uretrite, pielonefrite e infecções genitais femininas;
- infecções da pele e dos tecidos moles, como furúnculos, abscessos, celulite e ferimentos infectados;
- infecções dos ossos e das articulações, como osteomielite;
- outras infecções, como aborto séptico, sepse puerperal, sepse intra-abdominal, sepse, peritonite e infecções pós-cirúrgicas.
Clavulin® IV também é indicado para profilaxia de infecções que podem ser associadas a procedimentos cirúrgicos de grande porte, tais como gastrintestinais, pélvicos, de cabeça e pescoço, cardíacos, renais, de restauração de articulações e do trato biliar. Embora este medicamento seja indicado apenas para as condições listadas acima, as infecções causadas por microrganismos sensíveis à amoxicilina também podem ser tratadas com Clavulin® devido à presença desse fármaco em sua fórmula. Assim, as infecções mistas causadas por microrganismos sensíveis à amoxicilina e por microrganismos produtores de betalactamases sensíveis a Clavulin® não devem exigir a adição de outro antibiótico.
A sensibilidade ao Clavulin® irá variar com a região e com o tempo. Sempre que disponíveis, dados de sensibilidade locais devem ser consultados. Sempre que necessário, amostragem microbiológica e testes de sensibilidade devem ser realizados.
Resultados de eficácia.
Em um estudo comparativo e multicêntrico, foram randomizados 102 pacientes com diagnóstico de infecção de trato respiratório inferior e idade variando entre 3 meses e 12 anos, que receberam sulbactam-cefotaxime ou amoxicilina e clavulanato de potássio IV por até 7 dias. A taxa de sucesso clínico obtida foi de 93,9% para sulbactam-cefotaxime, e 89.8% para amoxicilina e clavulanato de potássio, não havendo portanto diferença estatística em relação à eficácia de ambas medicações (p < 0,05).
Fonte: Pareek A, et al. Comparative evaluation of efficacy and safety of cefotaxime-sulbactam with amoxicillin-clavulanic acid in children with lower respiratory tract infections. Expert Opin. Pharmacother. (2008) 9(16):2751-2757
Uma avaliação retrospectiva, que analisou 172 neonatos (aproximadamente. 19 dias de vida) que apresentaram diagnóstico confirmado de infecção do trato urinário e receberam tratamento endovenoso com amoxicilina+clavulanato de potássio e gentamicina ou ampicilina e gentamicina, demonstrou que ambos os tratamentos foram eficazes, não havendo portanto falência do tratamento ou recidiva da infecção. Aproximadamente 80% dos pacientes apresentaram -se afebril 24 horas após o início do tratamento. A duração média do tratamento endovenoso foi de 4 dias. Após este período o tratamento foi complementado com amoxicilina+clavulanato de potássio via oral. Fonte: Magín EC, et al. Efficacy of Short-Term Intravenous Antibiotic in Neonates With Urinary Tract Infection. Pediatric Emergency Care 2007; 23(2): 83-86.
Em um outro estudo clínico prospectivo, randomizado, multinacional que comparou o uso da terapia sequencial de moxifloxacino IV/VO 1x ao dia com amoxicilina + clavulanato de potássio IV/VO 3x ao dia por 7 a 21 dias em pacientes hospitalizados com diagnóstico de infecção de pele e tecidos moles, demonstrou que a taxa de sucesso clínico nos 804 pacientes avaliados foi de 80,6% para moxifloxacino e 84,5% para amoxicilina + clavulanato, não havendo portanto diferença estatística significativa entre ambos os medicamentos usados.
Fonte: Lohsiriwat D, et al. Efficacy and Safety of Parenteral Amoxycillin/Clavulanate for Prevention of Surgical Site Infection Following Abdominal Surgery. J Med Assoc Thai 2009; 92(9): 1167-70.
Caract. farmacológicas.
Clavulin® contém como princípios ativos a amoxicilina, quimicamente a D-(-)-alfa-amino-p-hidroxibenzilpenicilina, e o clavulanato de potássio, sal potássico do ácido clavulânico.
Clavulin® é um antibiótico de amplo espectro que possui a propriedade de atuar contra microrganismos gram-positivos e gram-negativos, produtores ou não de betalactamases.
A amoxicilina é uma penicilina semissintética com amplo espectro de ação e deriva do núcleo básico da penicilina, o ácido 6-aminopenicilânico. O ácido clavulânico é uma substância produzida pela fermentação do Streptomyces clavuligerus, que tem a propriedade especial de inativar de modo irreversível as enzimas betalactamases, permitindo, dessa forma, que os microrganismos se tornem sensíveis à rápida ação bactericida da amoxicilina. Ambos os sais possuem propriedades farmacocinéticas muito equivalentes.
Tanto a amoxicilina quanto o clavulanato de potássio são bem absorvidos não apenas pela via entérica como também pela parenteral. As concentrações séricas da amoxicilina alcançadas com o uso de Clavulin® são similares às produzidas pela administração de dosagens equivalentes e isoladas desse fármaco. A meia-vida da amoxicilina após a administração de Clavulin® é de 1,3 hora e a do ácido clavulânico é de 1,0 hora. Aproximadamente 60% a 70% de amoxicilina e 40% a 65% de ácido clavulânico são excretados na urina, sem modificações, durante as primeiras 6 horas após a administração.
Nenhum dos componentes de Clavulin® apresenta forte ligação proteica; o índice de ligação proteica do ácido clavulânico é de 25%, enquanto o da amoxicilina é de 18%.
A amoxicilina, como a maioria das penicilinas, pode ser detectada no leite materno. Com relação ao ácido clavulânico, não existem dados disponíveis a esse respeito.
A amoxicilina se espalha rapidamente nos tecidos e fluidos intersticiais, mas não no cérebro e seus fluidos. Os resultados de experimentos que envolvem a administração do ácido clavulânico em animais sugerem que essa substância, do mesmo modo que a amoxicilina, é bem distribuída pelos tecidos corporais.
Cada frasco-ampola de Clavulin® 500 mg + 100 mg contém 0,63 mEq de potássio e cada frasco-ampola de Clavulin® 1 g + 200 mg contém 1,26 mEq de potássio.
A amoxicilina é um antibiótico semissintético com largo espectro de atividade bactericida contra muitos microrganismos gram-positivos e gram-negativos. É também, todavia, suscetível à degradação por betalactamases; portanto, seu espectro de atividade não inclui os microrganismos que produzem essas enzimas.
O ácido clavulânico é um betalactâmico estruturalmente relacionado às penicilinas que possui a capacidade de inativar uma gama de enzimas betalactamases comumente encontradas em microrganismos resistentes às penicilinas e às cefalosporinas. Tem, em particular, boa atividade contra o plasmídeo mediador das betalactamases clinicamente importante para a transferência de resistência à droga.
Na lista abaixo, os microrganismos foram categorizados de acordo com a sensibilidade in vitro a amoxicilina/ clavulanato.
Espécies comumente sensíveis
Bactérias gram-positivas:
-aeróbias - Staphylococcus aureus (sensível a meticilina)*, Staphylococcus coagulase negativos (sensível a meticilina)*, Enterococcus faecalis*, Streptococcus pneumoniae*†, Streptococcus pyogenes*†, Streptococcus viridans†, Streptococcus agalactiae*†,, Bacillus anthracis, Listeria monocytogenes, Gardnerella vaginalis, Nocardia asteroides, Streptococcus sp. (outro bhemolítico)*†, Staphylococcus saprophyticus (sensível a meticilina).
-anaeróbias - Clostridium sp., Peptostreptococcus sp., Peptococcus niger, Peptostreptococcus magnus, Peptostreptococcus micros
Bactérias gram-negativas:
-aeróbias - Haemophilus influenzae*, Moraxella catarrhalis*, Neisseria gonorrhoeae, Bordetella pertussis, Vibrio cholerae, Pasteurella multocida,, Heliobacter pylori, Haemophilus parainfluenzae
-anaeróbias - Bacteroides sp. (inclusive B. fragilis), Fusobacterium sp., Capnocytophaga sp., Eikenella corrodens, Fusobacterium nucleatum, Porphyromonas sp., Prevotella sp.
Outras: Borrelia burgdorferi, Leptospira ictterohaemorrhagiae, Treponema pallidum
Espécies que a resistência adquirida pode se tornar um problema
Bactérias gram-negativas:
Aeróbias: Escherichia coli*, Klebsiella oxytoca, Klebsiella pneumoniae*, Klebsiella sp. Proteus mirabilis, Proteus vulgaris, Proteus sp., Salmonella sp., Shigella sp.
Bactérias gram-positivas: Aeróbias: Corynebacterium sp., Enterococcus faecium
Organismos inerentemente resistentes
Bactérias gram-negativas:
Aeróbias: Acinetobacter sp., Citrobacter freundii, Enterobacter sp., Hafnia alvei, Legionella pneumophila, Morganella morganii, Providencia sp., Pseudomonas sp., Serratia sp., Stenotrophomas maltophilia, Yersinia enterolitica
Outras: Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia sp., Coxiella burnetti, Mycoplasma sp.
* a eficácia clínica de amoxilicina-ácido clavulânico foi demonstrada em estudos clínicos
† microrganismos que não produzem beta-lactamase. Se um microrganismo isolado é sensível a amoxicilina, pode ser considerado sensível a Clavulin® .
Propriedades Farmacocinéticas
Os resultados dos estudos de farmacocinética nos quais Clavulin® foi administrado a grupos de indivíduos sadios como 500/100 (600) mg ou 100/200 (1,2g) por injeção i.v em bolus ou 2000/200 (2,2g) como infusão i.v por 30 minutos são apresentados abaixo.
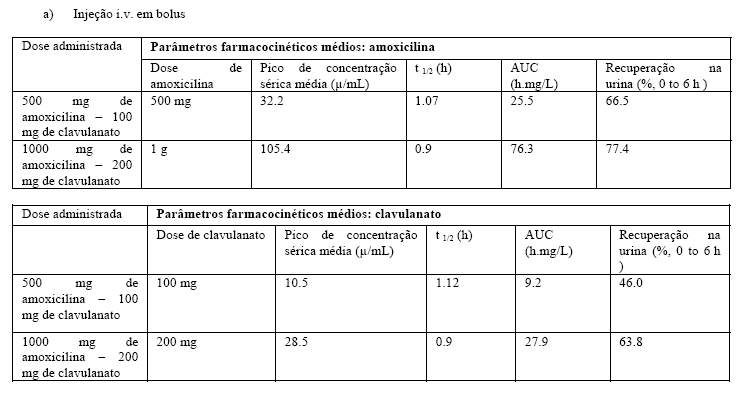

Absorção
Não aplicável.
Distribuição
Após a administração i.v, as concentrações terapêuticas de amoxicilina e ácido clavulânico podem ser detectadas nos tecidos e fluidos intersticiais. As concentrações terapêuticas de ambos os fármacos foram encontradas na vesícula biliar, tecidos abdominais, pele, tecido adiposo e muscular. Entre os fluidos em que foram encontrados níveis terapêuticos, estão os fluidos sinoviais e peritoniais, bile e pus.
Nem a amoxicilina ou o ácido clavulânico são altamente ligáveis a proteínas.
Estudos mostram que aproximadamente de 13% a 20% do conteúdo do fármaco plasmático total de cada componente é ligado a proteínas. Estudos realizados em animais não apresentaram evidências que sugerem que os componentes se acumulam em qualquer órgão.
A amoxicilina, assim como a maioria das penicilinas, pode ser detectada no leite materno. Traços de clavulanato também podem ser detectados no leite materno.
Com exceção do risco de sensibilização associado a essa excreção, não há efeitos prejudiciais conhecidos para o lactente.
Estudos de reprodução em animais mostraram que tanto a amoxicilina quanto o ácido clavulânico penetram a barreira placentária. No entanto, não há evidências de danos a fertilidade ou ao feto.
Eliminação
Assim como ocorre com outras penicilinas, a principal via de eliminação da amoxicilina é através dos rins, enquanto para o clavulanato a eliminação é tanto renal, quanto por mecanismos não-renais.
Aproximadamente de 60 a 70 % da amoxicilina e aproximadamente 40 a 65% do ácido clavulânico são excretados inalterados na urina durante as primeiras seis horas após a administração de uma administração única de 500/100 mg ou 1000/200 mg por injeção
i.v. em bolus.
O uso concomitante de probenecida e Clavulin® atrasa a excreção renal da amoxicilina mas não do clavulanato (ver Interações).
Metabolismo
A amoxicilina é excretada na urina como ácido peniciloico inativo em quantidades equivalentes a 10 a 25% da dose inicial. Ácido clavulânico é extensivamente metabolizado em homens a 2,5 dihidro-4-(2-hidroxietil)-5-oxo-1H-pirrol-3-ácido carboxílico e 1-amino-4-hidroxibuta-2-nona e eliminado na urina e fezes e como dióxido de carbono no ar expirado.
Contraindicações.
Clavulin® é contraindicado para pacientes com história de reações alérgicas, hipersensibilidade a penicilinas e disfunção hepática/icterícia associadas a este medicamento ou a outras penicilinas.
Deve-se dar atenção à possível sensibilidade cruzada com outros antibióticos betalactâmicos, como as cefalosporinas.
Advertências e precauções.
Antes de iniciar tratamento com um derivado penicilânico, deve-se realizar uma pesquisa criteriosa e minuciosa sobre o passado alérgico do paciente no que diz respeito a reações a penicilinas, cefalosporinas ou outros alérgenos.
Há relatos de reações de hipersensibilidade (anafilactoides) graves e ocasionalmente fatais em pacientes que recebem tratamento com derivados penicilânicos. Essas reações ocorrem, mais provavelmente, em indivíduos com história de hipersensibilidade à penicilina (ver Contraindicações).
Mudanças na função hepática foram observadas em alguns pacientes que recebiam Clavulin®. A importância clínica dessas mudanças é incerta, mas Clavulin® deve ser usado com cautela em pacientes com evidências de disfunção hepática grave. Houve relatos raros de icterícia colestática, que pode ser grave, mas geralmente reversível. Os sinais e sintomas podem não se tornar aparentes por até seis semanas após a interrupção do tratamento.
Para os pacientes com insuficiência renal, deve-se ajustar a dose de Clavulin® conforme se recomenda no item Posologia e Modo de Usar.
Deve-se evitar o uso de Clavulin® em pacientes sob suspeita de mononucleose, uma vez que a ocorrência de rash cutâneo de aspecto morbiliforme tem sido associada à amoxicilina em pacientes com essa condição.
O uso prolongado também pode ocasionalmente resultar em crescimento excessivo de organismos não sensíveis.
Foi relatada colite pseudomembranosa com o uso de antibióticos, que pode ter gravidade variada entre leve e risco à vida. Portanto, é importante considerar o diagnóstico de doentes que desenvolvam diarreia durante ou após o uso de antibióticos. Se ocorrer diarreia prolongada ou significativa, ou o paciente sentir cólicas abdominais, o tratamento deve ser interrompido imediatamente e a condição do paciente investigada.
Houve relatos raros de prolongamento anormal do tempo de protrombina (aumento da razão normalizada internacional, INR) em alguns pacientes que receberam tratamento com Clavulin® e anticoagulantes orais. Deve-se fazer o monitoramento apropriado quando anticoagulantes forem prescritos para uso concomitante.
Podem ser necessários ajustes de dose de anticoagulantes orais para manter o nível desejado de anticoagulação.
Se a administração parenteral de altas doses for necessária, deve-se considerar o teor de sódio dos pacientes sob dieta com restrição de sal.
Em pacientes com oligúria, muito raramente se observou cristalúria, predominantemente com terapia parenteral. Durante a administração de altas doses de Clavulin®, deve-se manter ingestão de líquidos e diurese adequadas a fim de minimizar a possibilidade de cristalúria (ver Superdosagem).
A presença do ácido clavulânico na fórmula de Clavulin® pode causar uma ligação não específica de IgG e albumina, pela membrana dos glóbulos vermelhos, levando a resultado falso-positivo do teste de Coombs.
Embora a anafilaxia seja mais frequente após tratamento parenteral, pode também ocorrer em pacientes que recebem terapia oral. Há relatos de casos de pacientes com história de hipersensibilidade à penicilina que tiveram graves reações quando tratados com cefalosporinas. Caso ocorra uma reação alérgica, deve-se descontinuar imediatamente o uso de Clavulin® e instituir terapia adequada. As reações anafilactoides graves requerem tratamento de emergência com epinefrina. Pode-se também, se necessário, instituir oxigênio, esteroides intravenosos e assistência respiratória, inclusive entubação.
Embora Clavulin® tenha a característica de baixa toxicidade do grupo dos antibióticos penicilânicos, recomenda-se, durante tratamentos prolongados, o acompanhamento periódico das funções orgânicas, inclusive a renal, a hepática e a hematopoiética.
Deve-se considerar a possibilidade de superinfecções por fungos ou bactérias durante o tratamento. Se ocorrer superinfecção (que usualmente envolve Pseudomonas ou Candida), recomenda-se descontinuar a droga e/ou instituir terapia apropriada.
Gravidez e lactação
Gravidez
Estudos sobre reprodução em animais (camundongos e ratos) nos quais Clavulin® foi administrado por via oral e parenteral não demonstraram efeitos teratogênicos. Em um único estudo, feito com mulheres pré-termo com ruptura precoce da bolsa amniótica relatou-se que o tratamento profilático com Clavulin® pode estar associado ao aumento do risco de enterocolite necrotizante em neonatos. Como ocorre com todos os medicamentos, deve-se evitar o uso de Clavulin® na gravidez, especialmente durante o primeiro trimestre, a menos que o médico o considere essencial.
Lactação
Clavulin® pode ser administrado durante o período de lactação. Com exceção do risco de sensibilização, associado à excreção de pequenas quantidades da droga no leite materno, não existem efeitos nocivos para a criança.
Categoria B de risco na gravidez
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Efeitos sobre a capacidade de dirigir veículos e de operar máquinas
Não se observaram efeitos sobre a capacidade de dirigir veículos e de operar máquinas.
Interações medicamentosas.
A probenecida retarda a excreção renal da amoxicilina. Seu uso concomitante com o de Clavulin® pode resultar em aumento e prolongamento do nível de amoxicilina no sangue, mas não de ácido clavulânico, não sendo, portanto, recomendável.
A administração concomitante de alopurinol e amoxicilina aumenta consideravelmente a incidência de rash em comparação com o uso isolado de amoxicilina. Não se sabe se essa potencialização do efeito da amoxicilina se deve ao alopurinol ou à hiperuricemia presente nesses casos. Não há dados sobre a administração concomitante de Clavulin® e alopurinol.
A ingestão de álcool deve ser evitada durante e vários dias após o tratamento com Clavulin® .
Clavulin® não deve ser administrado junto com dissulfiram.
Da mesma forma que outros antibióticos, Clavulin® pode afetar a flora intestinal e assim diminuir a reabsorção de estrógenos, levando à redução da eficácia dos contraceptivos orais combinados.
A presença do ácido clavulânico na fórmula de Clavulin® pode causar uma ligação não específica de IgG e albumina, pela membrana dos glóbulos vermelhos, levando a resultado falso-positivo do teste de Coombs.
Há, na literatura, raros casos de aumento da INR em pacientes em uso de acenocumarol ou varfarina que recebem um ciclo de tratamento com amoxicilina. Se a coadministração for necessária, o tempo de protrombina e a INR devem ser cuidadosamente monitorados sempre que se adiciona ou se interrompe o tratamento com Clavulin®.
Em pacientes que receberam micofenolato de mofetila, foi relatada uma redução na concentração do metabólito ativo ácido micofenólico de cerca de 50% após o início do uso de amoxicilina + ácido clavulânico por via oral. A mudança no nível pré-dose pode não representar com precisão alterações na exposição geral ao MPA.
Cuidados de armazenamento.
Cuidados de conservação
Conserve o produto ao abrigo da luz e da umidade e em temperatura não superior a 25°C. O prazo de validade é de 24 meses a partir da data de fabricação, impressa na embalagem do produto.
Para informações sobre a estabilidade de Clavulin® IV após a reconstituição, ver, em Posologia e Modo de Usar, o item Estabilidade e Compatibilidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto físico/características organolépticas
Frasco de vidro transparente, vedado com uma tampa de borracha de clorobutila e um lacre de alumínio que contém um nominal de 500 ou 1.000 mg de amoxicilina e 100 ou 200 mg de ácido clavulânico. O conteúdo do frasco é um pó cuja cor varia entre o branco e o creme.
Uma coloração rósea transitória pode ou não aparecer durante a reconstituição. As soluções reconstituídas são normalmente incolores ou de cor esbranquiçada a amarelada.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Posologia e modo de usar.
Administração
Clavulin® pode ser administrado tanto por injeção intravenosa como por infusão intermitente. Não é adequado para administração intramuscular.
- Clavulin® 500 mg + 100 mg: para reconstituir, dissolva em 10 mL de água para injeção (volume final 10,5 mL).
- Clavulin® 1 g + 200 mg: para reconstituir, dissolva em 20 mL de água para injeção (volume final 20,9 mL).
Uma coloração rósea transitória pode ou não aparecer durante a reconstituição. As soluções reconstituídas são normalmente incolores ou de cor esbranquiçada a amarelada.
Injeção intravenosa
A estabilidade da solução de Clavulin® IV depende da concentração; assim, Clavulin® IV deve ser usado imediatamente após a reconstituição e administrado por injeção intravenosa lenta pelo período de 3 a 4 minutos. Clavulin® IV deve ser usado no período de 20 minutos após a reconstituição. Não congele. A solução pode ser injetada diretamente na veia ou através de equipo.
Infusão intravenosa
Como alternativa, pode-se preparar infusão de Clavulin® IV com água para injeção ou injeção intravenosa de cloreto de sódio (0,9% p/v). Acrescente imediatamente o conteúdo de um frasco-ampola de Clavulin® 500 mg + 100 mg reconstituído a 50 mL com fluido para infusão ou o conteúdo de um frasco-ampola de Clavulin® 1,2 g (1 g + 200 mg) reconstituído a 100 mL com fluido para infusão. A infusão deve ser administrada durante o período de 30 a 40 minutos. As soluções assim reconstituídas, para infusão, quando misturadas com água estéril para injeção ou solução estéril de cloreto de sódio (0,9%) permanecem estáveis por até 4 horas se forem mantidas na temperatura de 25oC. Para obter informações sobre outros fluidos apropriados para infusão, ver (abaixo) o item Estabilidade e Compatibilidade. Quaisquer soluções residuais de antibiótico devem ser descartadas. Clavulin® IV não deve ser misturado a derivados do sangue, a outros fluidos proteináceos, tais como proteínas hidrolisadas, nem a emulsões de lipídeo intravenosas. Se Clavulin® IV for prescrito em conjunto com um aminoglicosídeo, os antibióticos não devem ser misturados na seringa, no frasco de fluido intravenoso nem através de equipo, uma vez que pode ocorrer perda de atividade do aminoglicosídeo em tais condições.
O tratamento pode ter início por via parenteral e continuar com uma preparação oral.
O tratamento não deve ser prolongado além de 14 dias sem revisão.
Estabilidade e compatibilidade
As infusões intravenosas de Clavulin® podem ser administradas em diferentes fluidos intravenosos. Pode-se manter concentrações satisfatórias do antibiótico a 5°C e a 25°C no volume recomendado dos fluidos para infusão mencionados abaixo. Uma vez reconstituídas e mantidas em temperatura ambiente, as infusões devem ser administradas dentro dos prazos estabelecidos.

As soluções reconstituídas não devem ser congeladas.
Clavulin® IV é menos estável em infusões que contêm glicose, dextrano ou bicarbonato. A solução reconstituída não deve, portanto, ser adicionada a tais infusões, mas pode ser injetada no tubo gotejador durante o período de 3 a 4 minutos.
Para armazenagem a 5oC, deve-se adicionar a solução reconstituída à bolsa para infusão pré-refrigerada. A bolsa pode ser armazenada por até 8 horas. A partir daí, a infusão deve ser administrada imediatamente após atingir a temperatura ambiente.

Posologia para tratamento de infecção
• Adultos e crianças acima de 12 anos
A dose usual de Clavulin® é de 1,2 g (1 g + 200 mg) de 8 em 8 horas. Em infecções mais graves, deve-se diminuir o intervalo para 6 horas.
• Crianças de 3 meses a 12 anos
A dose é de 30 mg/kg* de 8 em 8 horas. Em infecções mais graves, deve-se diminuir o intervalo para 6 horas.
• Crianças de 0 a 3 meses
A dose é de 30 mg/kg* a cada 12 horas para crianças prematuras ou recém-nascidas durante o período perinatal, aumentando para intervalos de 8 em 8 horas posteriormente.
* Cada dose de 30 mg de Clavulin® fornece 5 mg de ácido clavulânico e 25 mg de amoxicilina.
Posologia para profilaxia cirúrgica
• Adultos
A profilaxia cirúrgica com Clavulin® deve ter como objetivo proteger o paciente durante o período de risco de infecções. Dessa forma, para adultos, procedimentos que durem menos de 1 hora podem ser cobertos por 1,2 g (1 g + 200 mg) de Clavulin® IV administrado na indução da anestesia. Cirurgias mais longas requerem doses subsequentes de 1,2 g (1 g + 200 mg) de Clavulin® IV (até quatro doses em 24 horas). Essas doses são geralmente administradas em intervalos de 0, 8, 16 (e 24) horas. Pode-se continuar com tal esquema posológico durante vários dias se o procedimento aumentar significativamente o risco de infecções.
Sinais clínicos claros de infecção na cirurgia requerem um curso normal de terapia intravenosa ou oral com Clavulin® no pós-operatório.
Posologia para insuficiência renal
•Adultos

• Crianças
Reduções similares de dose podem ser feitas para crianças.
Posologia para insuficiência hepática
Para pacientes com insuficiência hepática, a definição da posologia deve ser feita com cautela, avaliando-se a função hepática a intervalos regulares.
Cada frasco de 1,2 g (1 g + 200 mg) de Clavulin® contém 1,0 mmol de potássio e 3,1 mmol de sódio (aproximadamente).
Reações adversas.
Usaram-se dados de extensos estudos clínicos para determinar a frequência das reações indesejáveis, de muito comuns a raras. A frequência de todas as outras reações indesejáveis (isto é, aquelas que ocorreram em nível menor que 1/10.000) foi determinada utilizando-se principalmente dados de pós-comercialização e se refere à taxa de relatos, e não à frequência real.
Utilizou-se a seguinte convenção na classificação por frequência das reações: muito comuns ( > 1/10); comuns ( > 1/100 e < 1/10); incomuns (≥1/1.000 e < 1/100); raras (≥1/10.000 e < 1/1.000); e muito raras ( < 1/10.000).
Reações comuns ( > 1/100 e < 1/10)
-candidíase mucocutânea, diarreia
Reações incomuns ( > 1/1.000 e < 1/100)
-tontura, dor de cabeça
-náusea, vômito, indigestão
-aumento moderado de AST e/ou ALT (em pacientes tratados com antibióticos betalactâmicos, mas o significado desse achado ainda é desconhecido)
-rash, prurido, urticária
Reações raras ( > 1/10.000 e < 1.000)
-leucopenia reversível (inclusive neutropenia) e trombocitopenia
-tromboflebite no sítio de administração
-eritema multiforme
Reações muito raras ( < 1/10.000)
-agranulocitose reversível e anemia hemolítica, prolongamento do tempo de sangramento e do tempo de protrombina
-edema angioneurótico, anafilaxia, síndrome semelhante à doença do soro e vasculite de hipersensibilidade
-convulsões (que podem ocorrer em pacientes com disfunção renal ou naqueles que recebem altas doses)
-agitação, ansiedade, insônia e confusão mental (reações raramente relatadas)
-colites associadas a antibióticos, inclusive colite pseudomembranosa e hemorrágica (ver Advertências e Precauções), menos prováveis após administração parenteral
-hepatite e icterícia colestática (eventos notados com outros penicilânicos e cefalosporínicos); os eventos hepáticos reportados ocorreram predominantemente em homens e idosos e podem estar associados a tratamento prolongado. Em geral, os sinais e sintomas (normalmente reversíveis) ocorrem durante ou logo depois do tratamento, mas em alguns casos podem não ser aparentes até várias semanas após o término do tratamento. As reações hepáticas podem ser graves, mas os relatos de morte são extremamente raros. Os óbitos ocorreram quase sempre em pacientes com doença subjacente grave ou que faziam uso de outros medicamentos cujo potencial de efeitos hepáticos indesejáveis era conhecido.
-síndrome de Stevens-Johnson, necrólise epidérmica tóxica, dermatite exfoliativa bolhosa e exantema pustuloso generalizado agudo
-nefrite intersticial, cristalúria (ver Superdose) Se ocorrer qualquer reação dermatológica de hipersensibilidade, o tratamento deve ser descontinuado.
Em casos de eventos adversos, notifique o Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou a Vigilância Sanitária Estadual ou Municipal.
Superdose.
É pouco provável que ocorram problemas causados por superdosagem de Clavulin®. Caso
sintomas gastrintestinais e distúrbios do balanço hidreletrolítico se tornem evidentes, deve-se instituir tratamento sintomático. Observou-se cristalúria causada pelo uso de amoxicilina, que em alguns casos levou à falência renal (ver o item Advertências e Precauções).
Clavulin® pode ser removido da circulação por hemodiálise.
Houve relatos de casos em que a amoxicilina precipitou em cateteres vesicais após administração intravenosa de altas doses. Nessas condições, a drenagem pelo cateter vesical deve ser checada regularmente.
Em caso de intoxicação ligue para 0800 722 6001 se você precisar de mais orientações.
Informações adicionais
A resistência a muitos antibióticos é causada por enzimas bacterianas que destroem o antibiótico antes que ele possa agir sobre o patógeno. O clavulanato existente na fórmula de Clavulin® antecipa esse mecanismo de defesa bloqueando as enzimas betalactamases e neutralizando, dessa forma, os organismos sensíveis ao rápido efeito bactericida da amoxicilina em concentrações prontamente atingidas no corpo.
Usado isoladamente, o clavulanato apresenta baixa atividade antibacteriana; entretanto, em associação com a amoxicilina, como em Clavulin®, torna-se um agente antibiótico de amplo espectro com larga aplicação em hospitais e na clínica geral.
A farmacocinética dos dois componentes de Clavulin® é quase equivalente. Tanto o clavulanato quanto a amoxicilina têm baixos níveis de ligação sérica; cerca de 70% permanecem livres no soro.
A duplicação da dosagem de Clavulin® pode aumentar os níveis séricos a valores proporcionalmente mais altos.
Dizeres legais.
M.S. 1.0107.0076
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Esta bula foi aprovada pela Anvisa em 30/10/2013.
CLAVULIN
GLAXOSMITHKLINE
Pó para suspensão oral
amoxicilina + clavulânico, ácido
Antibiótico.
Apresentações.
Pó para suspensão oral: embalagens com frasco de 100 mL (125 mg + 31,25 mg/5 mL ou 250 mg + 62,50 mg/5 mL) de suspensão.
Contém 1 copo dosador.
USO ORAL
USO ADULTO E PEDIÁTRICO (A PARTIR DE 2 MESES DE IDADE)
Composição.
Pó para suspensão oral
Cada dose de 5 mL de suspensão oral de 125 mg + 31,25 mg contém: amoxicilina (na forma de amoxicilina triidratada) 125 mg, ácido clavulânico (na forma de clavulanato de potássio) 31,25 mg, veículo* q.s.p. 5 mL
Cada dose de 5 mL de suspensão oral de 250 mg + 62,50 mg contém: amoxicilina (na forma de amoxicilina triidratada) 250 mg, ácido clavulânico (na forma de clavulanato de potássio) 62,50 mg, veículo* q.s.p. 5 mL
* Veículo: goma xantana, aspartame, ácido succínico, sílica coloidal anidra, hipromelose, aroma de laranja, aroma de framboesa, aroma de caramelo e dióxido de silício.
Indicações.
Clavulin®, deve ser utilizado de acordo com as diretrizes locais para prescrição de antibióticos e dados de sensibilidade
Clavulin® é indicado para tratamento das infecções bacterianas causadas por germes sensíveis aos componentes da fórmula.
Clavulin®, bactericida que atua contra ampla gama de microrganismos, é efetivo nas seguintes condições:
- infecções do trato respiratório superior (inclusive ouvido, nariz e garganta), como amigdalite, sinusite e otite média;
- infecções do trato respiratório inferior, como bronquite aguda e crônica, pneumonia lobar e broncopneumonia;
- infecções do trato geniturinário, como cistite, uretrite e pielonefrites;
- infecções de pele e tecidos moles, como furúnculos, abscessos, celulite e ferimentos infectados;
- infecções de ossos e articulações, como osteomielite;
- outras infecções, como aborto séptico, sepse puerperal e sepse intra-abdominal.
A sensibilidade ao Clavulin® irá variar com a região e com o tempo. Sempre que disponíveis, dados de sensibilidade locais devem ser consultados. Sempre que necessário, amostragem microbiológica e testes de sensibilidade devem ser realizados.
Embora Clavulin® seja indicado apenas para os processos infecciosos referidos anteriormente, as infecções causadas por germes sensíveis à amoxicilina (ampicilina) também podem ser tratadas com o medicamento devido à presença desse fármaco em sua fórmula.
Assim, as infecções mistas causadas por microrganismos sensíveis à amoxicilina e por microrganismos produtores de betalactamases sensíveis a Clavulin® não devem exigir a adição de outro antibiótico.
Resultados de eficácia.
Dados recentes indicam que as taxas de sucesso clínico para a amoxicilina /clavulanato no tratamento da infecção do trato respiratório e otite média aguda (OMA) são mantidas ~ 90%. A amoxicilina / clavulanato, é portanto, um tratamento de grande valia para as infecções do trato respiratório, em especial porque o médico muitas vezes não é capaz de determinar o patógeno causador subjacente, e nestes casos faz-se necessária a terapia empírica.(White AR, Kaye C, et al. Augmentin® (amoxicillin/clavulanate) in the treatment of community-acquired respiratory tract infection: a review of the continuing development of an innovative antimicrobial agent. Journal of Antimicrobial Chemotherapy (2004) 53, Suppl. S1, i3-i20).
Em um estudo duplo-cego envolvendo 324 pacientes com evidência clínica de pneumonia adquirida na comunidade (PAC) ou uma exacerbação aguda da bronquite crônica, que foram randomizados para receber tratamento de 10 dias com amoxicilina / clavulanato 875/125 mg duas vezes diária ou amoxicilina / ácido clavulânico 500/125 mg três vezes ao dia. No final da terapia, as taxas de sucesso clínico foram de 92,4% para o regime de duas vezes por dia e 94,2% para o de três vezes ao dia. (Balgos AA, Rodriguez-Gomez G, et al. Efficacy of twice-daily amoxycillin/clavulanate in lower respiratory tract infections. Int J Clin Pract. 1999; 53(5):325-30.)
Caract. farmacológicas.
Propriedades farmacodinâmicas
Código ATC J01CR02
Mecanismo de ação
Clavulin® é um antibiótico de amplo espectro que possui a propriedade de atuar contra microrganismos gram-positivos e gram-negativos, produtores ou não de betalactamases.
A amoxicilina é uma penicilina semissintética com amplo espectro de ação e deriva do núcleo básico da penicilina, o ácido 6-aminopenicilânico. O ácido clavulânico é uma substância produzida pela fermentação do Streptomyces clavuligerus, que possui a propriedade especial de inativar de modo irreversível as enzimas betalactamases, permitindo, dessa forma, que os microrganismos se tornem sensíveis à rápida ação bactericida da amoxicilina. Ambos os sais possuem propriedades farmacocinéticas muito equivalentes: os níveis máximos ocorrem 1 hora após a administração oral, têm baixa ligação proteica e podem ser administrados com as refeições porque permanecem estáveis na presença do ácido clorídrico do suco gástrico.
Clavulin® contém como princípios ativos a amoxicilina, quimicamente D-(-)-alfa-amino-p-hidroxibenzilpenicilina, e o clavulanato de potássio, sal potássico do ácido clavulânico.
O ácido clavulânico é um betalactâmico estruturalmente relacionado às penicilinas que possui a capacidade de inativar uma gama de enzimas betalactamases comumente encontradas em microrganismos resistentes às penicilinas e às cefalosporinas. Tem, em particular, boa atividade contra o plasmídeo mediador das betalactamases, clinicamente importante para a transferência de resistência à droga. A formulação da amoxicilina com o ácido clavulânico em Clavulin® protege a amoxicilina da degradação das enzimas betalactamases e estende de forma efetiva o espectro antibiótico desse fármaco por abranger muitas bactérias normalmente resistentes a esse e a outros antibióticos betalactâmicos. Assim, Clavulin® possui a propriedade única de antibiótico de amplo espectro e de inibidor de betalactamases.
A amoxicilina é um antibiótico com largo espectro de atividade bactericida contra muitos microrganismos gram-positivos e gram-negativos. É, todavia, suscetível à degradação por betalactamases; portanto, seu espectro de atividade não inclui os organismos que produzem essas enzimas.
Efeitos Farmacodinâmicos
Na lista abaixo, os microrganismos foram categorizados de acordo com a sensibilidade in vitro a amoxicilina/ clavulanato.
Espécies comumente sensíveis
Bactérias gram-positivas:
-aeróbias - Staphylococcus aureus (sensível a meticilina)*, Staphylococcus saprophyticus (sensível a meticilina), Staphylococcus coagulase-negativo (sensível a meticilina), Enterococcus faecalis, Streptococcus pyogenes*†, Bacillus anthracis, Listeria monocytogenes, Nocardia asteroides, Streptococcus agalactiae*†, Streptococcus spp. (outros b-hemolíticos)*† .
-anaeróbias - Clostridium sp., Peptococcus niger, Peptostreptococcus magnus, Peptostreptococcus micros, Peptostreptococcus spp.
Bactérias gram-negativas:
-aeróbias - Bordetella pertussis, Haemophilus influenzae*, Haemophilus parainfluenzae, Helicobacter pylori, Moraxella catarrhalis*, *Neisseria gonorrhoeae, Vibrio cholerae, Pasteurella multocida. -anaeróbias - Bacteroides spp. (inclusive B. fragilis), Canpnocytophaga spp., Eikenella corrodens, Fusobacterium spp. (inclusive F. nucleatum), Porphyromonas spp. Prevotella spp.
Outras: Borrelia burgdorferi, Leptospira ictterohaemorrhagiae, Treponema pallidum.
Espécies que a resistência adquirida pode se tornar um problema
Bactérias gram-negativas:
Aeróbias: Escherichia coli*, Klebsiella oxytoca, Klebsiella pneumoniae*, Klebsiella spp. Proteus mirabilis, Proteus vulgaris, Proteus spp., Salmonella spp., Shigella spp.
Bactérias gram-positivas:
Aeróbias: Corynebacterium sp., Enterococcus faecium, Streptococcus pneumoniae*†, Streptococcus do grupo Viridans.
Organismos inerentemente resistentes
Bactérias gram-negativas:
Aeróbias: Acinetobacter spp., Citrobacter freundii, Enterobacter spp., Hafnia alvei, Legionella pneumophila, Morganella morganii, Providencia spp., Pseudomonas spp., Serratia spp., Stenotrophomas maltophilia, Yersinia enterolitica
Outras: Chlamydia pneumoniae, Chlamydia psittaci, Chlamydia spp., Coxiella burnetti, Mycoplasma spp.
* a eficácia clínica de amoxilicina-ácido clavulânico foi demonstrada em estudos clínicos
† microrganismos que não produzem beta-lactamase. Se um microrganismo isolado é sensível a amoxicilina, pode ser considerado sensível a Clavulin® .
Propriedades farmacocinéticas
Absorção
Os dois componentes, de amoxicilina-clavulanato, amoxicilina e ácido clavulânico são totalmente dissociados em solução aquosa em pH fisiológico. Ambos os componentes são rapidamente e bem absorvidos por administração via oral. Absorção de amoxicilinaclavulanato é otimizado quando tomada no início de uma refeição.
As concentrações séricas da amoxicilina alcançadas com o uso de Clavulin® são similares às produzidas pela administração de dosagens equivalentes e isoladas desse fármaco. A meia-vida da amoxicilina após a administração de Clavulin® é de 1,3 hora e a do ácido clavulânico de 1,0 hora.
São apresentados na tabela abaixo, os resultados farmacocinéticos de dois estudos separados, em que a amoxicilina-clavulanato 250/125 (375) ou 2 x 250/125 e 500/125 (625) mg em comprimidos (em comparação com os dois ativos dados separadamente) foram administrados em jejum.
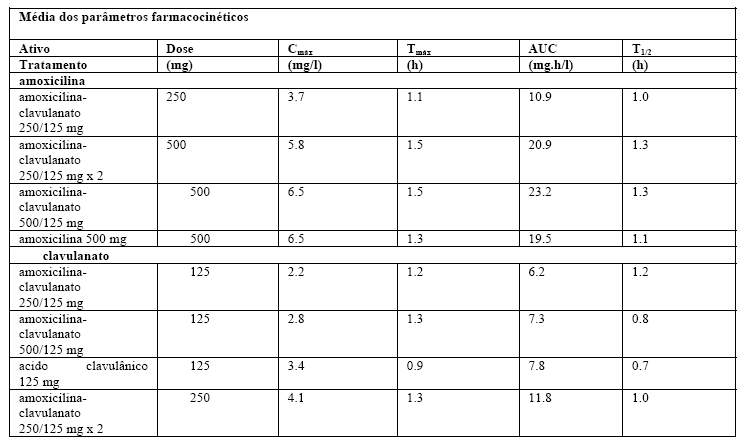
As concentrações séricas de amoxicilina obtidas com amoxicilina-clavulanato são semelhantes àquelas produzidas pela administração oral de doses equivalentes de amoxicilina isolada.
Distribuição
Estudos de reprodução em animais demonstraram que tanto a amoxicilina quanto o ácido clavulânico penetram na barreira placentária. No entanto, não foi detectada nenhuma evidência de diminuição da fertilidade ou dano ao feto.
Nenhum dos componentes de Clavulin® apresenta forte ligação protéica; o percentual de ligação protéica do ácido clavulânico é de aproximadamente 25%, enquanto o da amoxicilina é de 18%.
A amoxicilina, como a maioria das penicilinas, pode ser detectada no leite materno. Com relação ao ácido clavulânico, não existem dados disponíveis a esse respeito. Traços de clavulanato também podem ser detectados. Com exceção do risco de sensibilização associado a esta excreção, não são conhecidos efeitos nocivos ao lactente.
Os estudos de reprodução em animais demonstraram que tanto a amoxicilina quanto o ácido clavulânico penetram na barreira placentária. No entanto, nenhuma evidência de diminuição da fertilidade ou dano ao feto foi detectado.
Não há evidências em estudos animais que os componentes do Clavulin® se acumulam em algum órgão.
A amoxicilina distribui-se rapidamente nos tecidos e fluidos do corpo, mas não no cérebro e seus fluidos. Os resultados de experimentos que envolveram a administração do ácido clavulânico em animais sugerem que essa substância, do mesmo modo que a amoxicilina, é bem distribuída pelos tecidos corporais.
Metabolismo
A amoxicilina é parcialmente excretada na urina na forma de ácido penicilóico em quantidades equivalentes a 10- 25% da dose inicial. O ácido clavulânico é amplamente metabolizado em 2,5 - diidro-4-(2-hidroxietil)-5-oxo-1H-pirrol-3 ácido carboxílico e 1-amino-4-hidroxi-butan-2-ona sendo eliminado na urina e fezes.
Eliminação
Como com outras penicilinas, a principal via de eliminação da amoxicilina é através dos rins, enquanto que para clavulanato os mecanismos de eliminação são renal e não-renal.
Aproximadamente 60% a 70% de amoxicilina e 40% a 65% de ácido clavulânico são excretados sem modificações na urina durante as primeiras 6 horas após a administração de dose única de um comprimido de 500 mg ou de 10 mL de suspensão oral de 250 mg de Clavulin® .
O uso concomitante de probenecida retarda a excreção de amoxicilina, mas não a excreção renal de ácido clavulânico (ver Interações Medicamentosas).
Contraindicações.
Clavulin® é contraindicado para pacientes com história de reações alérgicas, hipersensibilidade a penicilinas e disfunção hepática/icterícia associadas a este medicamento ou a outras penicilinas.
Deve-se dar atenção à possível sensibilidade cruzada com outros antibióticos betalactâmicos, como as cefalosporinas.
Advertências e precauções.
Antes de iniciar o tratamento com Clavulin®, deve-se fazer uma pesquisa cuidadosa sobre as reações prévias de hipersensibilidade a penicilinas e cefalosporinas ou a outros alérgenos.
Há relatos de reações de hipersensibilidade (anafilactoides) graves e ocasionalmente fatais em pacientes que recebem tratamento com derivados penicilânicos (ver Contraindicações). Essas reações ocorrem, mais provavelmente, em indivíduos com história de hipersensibilidade à penicilina e/ou a múltiplos alérgenos. Caso haja reação alérgica, recomenda-se descontinuar imediatamente o uso de Clavulin® e instituir uma terapia adequada. As reações anafilactoides graves requerem tratamento de emergência com epinefrina. Se necessário, pode-se também instituir oxigênio, esteroides intravenosos e assistência respiratória, inclusive entubação.
Deve-se evitar o uso de Clavulin® em pacientes sob suspeita de mononucleose, uma vez que a ocorrência de rash cutâneo de aspecto morbiliforme tem sido associada à amoxicilina.
O uso prolongado também pode, ocasionalmente, resultar em crescimento excessivo de organismos não suscetíveis.
Foi relatada colite pseudomembranosa com o uso de antibióticos, que pode ter gravidade variada entre leve e risco à vida. Portanto, é importante considerar o diagnóstico de doentes que desenvolvam diarreia durante ou após o uso de antibióticos. Se ocorrer diarreia prolongada ou significativa, ou o paciente sentir cólicas abdominais, o tratamento deve ser interrompido imediatamente e a condição do paciente investigada.
Houve relatos raros de prolongamento anormal do tempo de protrombina (aumento da razão normalizada internacional, INR) em alguns pacientes que receberam tratamento com Clavulin® e anticoagulantes orais. Deve-se fazer o monitoramento apropriado quando anticoagulantes forem prescritos para uso concomitante.
Podem ser necessários ajustes de dose de anticoagulantes orais para manter o nível desejado de anticoagulação.
Observaram-se mudanças da função hepática em alguns pacientes sob tratamento com Clavulin®. A importância clínica dessas mudanças é incerta, mas Clavulin® deve ser usado com cautela em pacientes que apresentam evidência de disfunção hepática.
Houve relatos raros de icterícia colestática, que pode ser grave, mas geralmente é reversível. Os sinais e sintomas talvez não se manifestem no período de até seis semanas após a interrupção do tratamento.
Para os pacientes com disfunção renal, deve-se ajustar a dosagem (ver Posologia e Modo de Usar).
Nos pacientes que apresentaram redução do volume de produção de urina, muito raramente se observou cristalúria, que ocorreu sobretudo com terapia parenteral. Durante a administração de altas doses de Clavulin®, deve-se manter ingestão adequada de líquidos, assim como eliminação normal de urina, a fim de minimizar a possibilidade de cristalúria.
A insuficiência renal não retarda a excreção do clavulanato de potássio nem da amoxicilina. Contudo, para os pacientes com insuficiência renal moderada ou grave, deve-se ajustar a dose de Clavulin® (ver Posologia e Modo de Usar).
Embora Clavulin® tenha a característica de baixa toxicidade do grupo dos antibióticos penicilânicos, recomenda-se, durante tratamentos prolongados, o acompanhamento periódico das funções orgânicas, inclusive renais, hepáticas e hematopoiéticas.
Deve-se considerar a possibilidade de superinfecções por fungos ou bactérias durante o tratamento. Se ocorrer superinfecção (que usualmente envolve Pseudomonas ou Candida), recomenda-se descontinuar a droga e/ou instituir terapia apropriada.
Clavulin® em suspensão contém 12,5 mg de aspartame por dose de 5 mL. Como o aspartame é fonte de fenilalanina, deve-se usar Clavulin® suspensão com cautela nos pacientes que têm fenilcetonúria.
Atenção, fenilcetonúricos: este medicamento contém fenilalanina.
Efeitos sobre a capacidade de dirigir veículos e de operar máquinas
Não se observaram efeitos sobre a capacidade de dirigir veículos e de operar máquinas.
Gravidez e lactação
Gravidez
Estudos sobre reprodução em animais (camundongos e ratos) nos quais Clavulin® foi administrado por via oral e parenteral não demonstraram efeitos teratogênicos. Em um único estudo, feito com mulheres que haviam tido parto prematuro com ruptura precoce da bolsa amniótica, relatou-se que o uso profilático de Clavulin® pode estar associado ao aumento do risco de o neonato apresentar enterocolite necrotizante. Como ocorre com todos os medicamentos, deve-se evitar o uso de Clavulin® na gravidez, especialmente durante o primeiro trimestre, a menos que o médico o considere essencial.
Lactação
Clavulin® pode ser administrado durante o período de lactação. Com exceção do risco de sensibilidade associado à excreção de pequenas quantidades da droga no leite materno, não existem efeitos nocivos para a criança.
Categoria B de risco na gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Interações medicamentosas.
A probenecida retarda a excreção renal da amoxicilina. Seu uso concomitante com o de Clavulin® pode resultar em aumento e prolongamento do nível de amoxicilina no sangue, mas não de ácido clavulânico, não sendo, portanto, recomendável.
A administração concomitante de alopurinol e amoxicilina aumenta consideravelmente a incidência de rash em comparação ao uso isolado de amoxicilina. Não se sabe se essa potencialização do efeito da amoxicilina se deve ao alopurinol ou à hiperuricemia presente nesses casos. Não há dados sobre a administração concomitante de Clavulin® e alopurinol. Da mesma forma que outros antibióticos, este medicamento pode afetar a flora intestinal e assim reduzir a reabsorção de estrógenos. Por isso, se Clavulin® for usado em combinação com contraceptivos orais, a eficácia destes últimos pode reduzir-se.
A ingestão de álcool deve ser evitada durante e vários dias após o tratamento com Clavulin® .
Clavulin® não deve ser administrado junto com dissulfiram.
Relatou-se prolongamento do tempo de sangramento e do tempo de protrombina em alguns pacientes tratados com Clavulin®. Assim, este medicamento deve ser usado com cautela em pacientes sob tratamento com anticoagulantes.
Há, na literatura, raros casos de aumento da INR em pacientes em uso de acenocumarol ou varfarina que recebem um ciclo de tratamento com amoxicilina. Se a coadministração for necessária, o tempo de protrombina e a INR devem ser cuidadosamente monitorados com a adição ou interrupção da terapia com Clavulin® .
Em pacientes que receberam micofenolato de mofetila, foi relatada uma redução na concentração do metabólito ativo ácido micofenólico de cerca de 50% após o início do uso de amoxicilina + ácido clavulânico por via oral. A mudança no nível pré-dose pode não representar com precisão alterações na exposição geral ao MPA.
Cuidados de armazenamento.
Cuidados de conservação
Conserve o produto ao abrigo da umidade e em temperatura ambiente (entre 15°C e 30°C). O prazo de validade é de 24 meses a partir da data de fabricação, impressa na embalagem do produto.
A suspensão oral, após a reconstituição, ficará estável por sete dias, devendo, para isso, ser conservada em geladeira (2°C a 8°C).
Sem refrigeração, a suspensão escurece gradativamente, apresentando coloração amarelo-escura após 48 horas e marrom-tijolo em 96 horas. Depois de oito dias, mesmo guardada em geladeira, a suspensão torna-se amarelo-escura e, em dez dias, passa a marrom-tijolo. Portanto, após sete dias, o produto deve ser descartado.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após o preparo, manter por sete dias em geladeira.
Aspecto físico/características organolépticas
Pó fino de cor branca, com odor e sabor de laranja, isento de partículas estranhas.
Tanto o pó quanto a suspensão apresentam, imediatamente após a reconstituição, uma coloração que pode variar do branco ao creme.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
Posologia e modo de usar.
Modo de usar
Para minimizar a potencial intolerância gastrintestinal, deve-se administrar o medicamento no início da refeição. Essa forma de administração favorece a absorção de Clavulin® .
O tratamento não deve ser estendido por mais de 14 dias sem revisão.
Instruções para reconstituição
IMPORTANTE: AGITE O FRASCO ANTES DE ABRI-LO ATÉ DEIXAR O PÓ SOLTO. ISSO FACILITARÁ A RECONSTITUIÇÃO.
1. Clavulin® tem uma tampa de alumínio. Para abri-la, gire-a no sentido anti-horário, conforme a Figura 1.
2. Adicione água filtrada (em temperatura ambiente) até atingir a marca indicada no rótulo do frasco. Recoloque a tampa e agite bem até que o pó se misture totalmente com a água.
3. Espere a espuma baixar e veja se a suspensão atinge realmente a marca indicada no frasco. Se não atingir exatamente a marca, adicione mais água filtrada (em temperatura ambiente) até chegar ao nível certo. Agite novamente e espere até que o produto (sem espuma) atinja a marca indicada no frasco. Repita o procedimento quantas vezes forem necessárias até que o produto atinja o nível correto.
4. Abra novamente a tampa de Clavulin® e encha o copo dosador até a dosagem prescrita. As doses estão discriminadas em mL no copo dosador.

5. Vire o copo para verter todo o medicamento na boca (Figura 5). Lave bem o copo dosador após a utilização.
Lembre-se de guardar o produto na geladeira pelo período máximo de sete dias e de AGITAR O FRASCO TODA VEZ QUE ADMINISTRAR AS DOSES.
EM CASO DE DÚVIDA NA PREPARAÇÃO/ADMINISTRAÇÃO OU PARA OBTER MAIS INFORMAÇÕES, ENTRE EMCONTATO COM O SERVIÇO DE ATENDIMENTO AO CONSUMIDOR (SAC) ATRAVÉS DO DDG 0800 701 22 33.
Tanto o pó quanto a suspensão apresentam, imediatamente após a reconstituição, uma coloração que pode variar do branco ao creme. A suspensão oral, após a reconstituição, ficará estável por sete dias, devendo, para isso, ser conservada em geladeira (2°C a 8°C). Sem refrigeração, a suspensão escurece gradativamente, apresentando coloração amarelo-escura após 48 horas e marrom-tijolo em 96 horas. Depois de oito dias, mesmo guardada em geladeira, a suspensão torna-se amarelo-escura e, em dez dias, passa a marrom-tijolo. Portanto, após sete dias, o produto deve ser descartado.
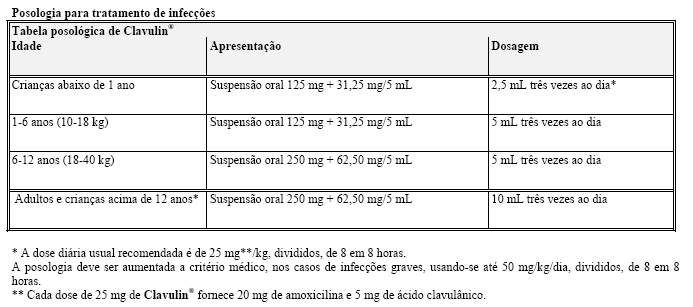
-Posologia para insuficiência renal
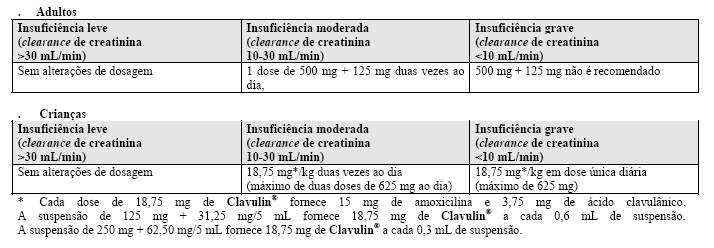
A suspensão de 125 mg + 31,25 mg/5 mL fornece 18,75 mg de Clavulin® a cada 0,6 mL de suspensão. A suspensão de 250 mg + 62,50 mg/5 mL fornece 18,75 mg de Clavulin® a cada 0,3 mL de suspensão.
-Posologia para insuficiência hepática
O tratamento deve ser cauteloso; monitore a função hepática em intervalos regulares. Em casos de infecção grave, a posologia deve ser aumentada de acordo com as instruções médicas. Em crianças que pesam 40 kg ou mais, deve-se aplicar a posologia para adultos.
Reações adversas.
Usaram-se dados de estudos clínicos feitos com grande número de pacientes para determinar a frequência das reações indesejáveis (de muito comuns a raras). A frequência de todas as outras reações indesejáveis (isto é, aquelas que ocorreram em nível menor que 1/10.000) foi determinada utilizando-se principalmente dados de pós-comercialização e se refere à taxa de relatos, e não à frequência real.
Utilizou-se a seguinte convenção na classificação da frequência das reações: muito comuns ( > 1/10), comuns ( > 1/100 e < 1/10), incomuns ( > 1/1.000 e < 1/100), raras ( > 1/10.000 e < 1/1.000) e muito raras ( < 1/10.000).
Reações muito comuns ( > 1/10): diarreia (em adultos)
Reações comuns ( > 1/100 e < 1/10)
-candidíase mucocutânea
-náusea e vômitos (em adultos)*
-diarreia, náusea e vômitos (em crianças)*
-vaginite
Reações incomuns ( > 1/1.000 e < 1/100)
-tonteira
-dor de cabeça
-indigestão
-aumento moderado de AST e/ou ALT em pacientes tratados com antibióticos betalactâmicos, mas o significado desse achado ainda é desconhecido**
-rash, prurido e urticária
Reações raras ( > 1/10.000 e < 1/1.000)
-leucopenia reversível (inclusive neutropenia) e trombocitopenia -eritema multiforme
Reações muito raras ( < 1/10.000)
-agranulocitose reversível e anemia hemolítica, prolongamento do tempo de sangramento e do tempo de protrombina
-edema angioneurótico, anafilaxia, síndrome semelhante à doença do soro e vasculite de hipersensibilidade
-hiperatividade reversível e convulsões (estas podem ocorrer em pacientes com função renal reduzida ou naqueles que tomam altas doses)
-colite associada a antibióticos (entre elas, colite pseudomembranosa e hemorrágica) (ver Advertências e Precauções)
-houve relatos muito raros de descoloração superficial dos dentes em crianças; uma boa higiene oral pode ajudar a prevenir a descoloração dos dentes, já que o produto é normalmente removido pela escovação
-língua pilosa negra
-hepatite e icterícia colestática (esses eventos foram observados também com outros penicilínicos e cefalosporínicos)**
-síndrome de Stevens-Johnson, necrólise epidérmica tóxica, dermatite exfoliativa bolhosa e exantema pustuloso generalizado agudo
-nefrite intersticial e cristalúria
Outras reações adversas
-trombocitopenia púrpura
-ansiedade, insônia e confusão mental
-glossite
Se ocorrer qualquer reação dermatológica de hipersensibilidade, o tratamento deve ser descontinuado.
* A náusea está comumente associada a altas dosagens orais. Caso reações gastrintestinais se tornem evidentes, é possível minimizá-las administrando-se a dose do produto no início das refeições.
** Houve relatos de eventos hepáticos, predominantemente em homens e idosos, que podem estar associados a tratamentos prolongados. São muito raros os relatos desses eventos em crianças.
Crianças e adultos: alguns sinais e sintomas usualmente ocorrem durante o tratamento ou logo após, mas em certos casos podem não se tornar aparentes até várias semanas depois do término da terapia. São normalmente reversíveis. Os eventos hepáticos podem ser graves; em circunstâncias extremamente raras, houve relatos de mortes. Estas ocorreram quase sempre entre pacientes com doença subjacente grave ou que faziam uso de outros medicamentos com conhecido potencial para causar efeitos hepáticos indesejáveis.
Em casos de eventos adversos, notifique o Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou a Vigilância Sanitária Estadual ou Municipal.
Superdose.
É pouco provável que ocorram problemas causados por superdosagem de Clavulin®. Caso sintomas gastrintestinais e distúrbios do balanço hidreletrolítico se tornem evidentes, deve-se instituir tratamento sintomático.
A amoxicilina pode ser removida da circulação por hemodiálise. O peso molecular, o grau de ligação proteica e o perfil farmacocinético do ácido clavulânico, em conjunto com informações de um paciente com insuficiência renal, sugerem que essa droga também pode ser removida por hemodiálise.
Observou-se cristalúria causada pelo uso de amoxicilina, que em alguns casos levou à falência renal (ver Advertências e Precauções).
Em caso de intoxicação ligue para 0800 722 6001 se você precisar de mais orientações.
INFORMAÇÕES ADICIONAIS
A resistência a muitos dos antibióticos é causada por enzimas bacterianas que os destroem antes que eles possam agir sobre o patógeno. O clavulanato existente em Clavulin® antecipa esse mecanismo de defesa bloqueando as enzimas betalactamases e, dessa forma, neutralizando os organismos sensíveis ao rápido efeito bactericida da amoxicilina em concentrações prontamente atingidas no corpo.
Usado isoladamente, o clavulanato apresenta baixa atividade antibacteriana; entretanto, em associação com a amoxicilina, como em Clavulin®, produz um agente antibiótico de amplo espectro e de larga aplicação em hospitais e na clínica geral.
A farmacocinética dos dois componentes de Clavulin® é quase equivalente. O pico dos níveis séricos das duas substâncias ocorre cerca de 1 hora após a administração oral. A absorção de Clavulin® é favorecida no início da refeição. Tanto o clavulanato quanto a amoxicilina têm baixos níveis de ligação sérica; cerca de 70% permanecem livres no soro.
A duplicação da dosagem de Clavulin® pode aumentar os níveis séricos a valores proporcionalmente mais altos.
Dizeres legais.
M.S. 1.0107.0076
VENDA SOB PRESCRIÇÃO MÉDICA.
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Esta bula foi aprovada pela Anvisa em 30/10/2013.

