CEFTRIAXONA (GENÉRICO)
EUROFARMA
ceftriaxona
Antibiótico.
Apresentações.
APRESENTAÇÕES
Pó para solução injetável para administração intramuscular (IM) 500 mg: embalagens com 1 frasco-ampola contendo o equivalente a 500 mg de ceftriaxona e 1 ou 5 ampolas de solução diluente (lidocaína 1%) com 2 mL.
Pó para solução injetável para administração intramuscular (IM) 1g: embalagens com 1 frasco-ampola contendo o equivalente a 1 g de ceftriaxona e 1 ampola de solução diluente (lidocaína 1%) com 3,5 mL.
USO INTRAMUSCULAR
USO ADULTO E PEDIÁTRICO
Composição.
ceftriaxona sódica - 500 mg. Cada frasco-ampola contém: ceftriaxona sódica hemieptaidratada* 596,66 mg; *Cada 596,66 mg de ceftriaxona sódica hemieptaidratada equivalem à 500 mg de ceftriaxona base.
ceftriaxona sódica - 1 g. Cada frasco-ampola contém: ceftriaxona sódica hemieptaidratada* 1,193 g. *Cada 1,193 g de ceftriaxona sódica hemieptaidratada equivalem à 1 g de ceftriaxona base.
A cada 1 grama de ceftriaxona sódica contém aproximadamente 83 mg (3,6 mEq) de sódio
Cada 1 mL de solução diluente (lidocaína 1%) contém: cloridrato de lidocaína 10 mg; excipientes* q.s.p. 1 mL. *Excipientes: cloreto de sódio, metilparabeno, ácido clorídrico, hidróxido de sódio e água para injetáveis.
Informações técnicas.
1. INDICAÇÕES
Este medicamento é indicado para o tratamento de infecções causadas por microrganismos sensíveis à ceftriaxona, como:
- Sepse;
- Meningite;
- Borreliose de Lyme disseminada (estágios iniciais e tardios da doença) (Doença de Lyme);
- Infecções intra-abdominais (peritonites, infecções do trato gastrintestinal e biliar);
- Infecções ósseas, articulares, tecidos moles, pele e feridas;
- Infecções em pacientes imunocomprometidos;
- Infecções renais e do trato urinário;
- Infecções do trato respiratório, particularmente pneumonia e infecções otorrinolaringológicas;
- Infecções genitais, inclusive gonorreia;
- Profilaxia perioperatória de infecções.
2. RESULTADOS DE EFICÁCIA
O tratamento com ceftriaxona é eficaz em infecções de gravidade variável, incluindo a sepse neonatal e em adultos, causadas por microrganismos sensíveis (Stone et al, 1984; Ghosen et al, 1981; Wiese,1988).
É indicado no tratamento empírico da meningite em crianças acima de 1 ano associado à ampicilina (Feigin et al, 1992). Sua eficácia em adultos é comparável à da associação ampicilina e cloranfenicol (Girgis et al, 1988) e, em crianças, aos seguintes antibióticos: cloranfenicol, ampicilina (isolados ou em associação), cefepima e cefotaxima, com a vantagem de posologia apenas 1 vez ao dia (Girgis et al, 1988; Saez-Llorens & O'Ryan, 2001; Peltola et al, 1989).
No tratamento das infecções respiratórias agudas ou crônicas agudizadas sua eficácia é observada em crianças, adultos e idosos, na pneumonia comunitária e hospitalar, de gravidade variável, e em casos graves (Rascio et al,1985; Grossman et al, 1999; Garber et al, 1992; Keller & Humair, 1981; Brogden & Ward,1988; Mangi et al, 1992).
Seu uso em dose única no tratamento da otite média aguda em crianças tem eficácia similar à do tratamento durante 7 a 10 dias com amoxicilina, associação amoxicilina e ácido clavulânico e sulfametoxazol e trimetoprima e tem sua indicação como alternativa quando a aderência ao tratamento for questionável (Varsano et al, 1988; Cohen et al,1999, Barnett et al,1997).
A ceftriaxona mostrou-se eficaz no tratamento das infecções renais e do trato urinário, não-complicadas e complicadas (Brogden & Ward, 1988; Iravani & Richard, 1985). Sua eficácia e segurança também foram demonstradas em mulheres grávidas (Wing et al,1998), crianças e adolescentes (Komoroski et al, 1999).
No tratamento da peritonite bacteriana espontânea em pacientes cirróticos, ocorre cura bacteriológica de até 100% em 48 horas (Gomez-Jimenez et al, 1993). Na febre tifóide seu uso é seguro e eficaz, em adultos e crianças, comparável ao cloranfenicol (Moosa & Rubidge, 1989). Nas diarreias causadas por Shigella, Salmonella, E. coli e Campylobacter, em crianças, tem eficácia similar quando comparado ao ciprofloxacino (Leibovitz et al, 2000).
Sua eficácia também é observada no tratamento empírico de infecções bacterianas em crianças e adultos imunocomprometidos com neutropenia febril e câncer (Hoepelman et al, 1988; Menichetti et al, 1990; Ariffin et al, 2001). Nesses pacientes, o uso de ceftriaxona diário, uma vez ao dia, é mais custo-efetivo do que a ceftazidima, três doses ao dia, ambos em associação à amicacina (Rossini et al, 1998; Ariffin et al, 2001).
Na profilaxia perioperatória de infecções, sua administração em dose única no pré-operatório tem eficácia superior ou igual a outros antibióticos administrados em múltiplas doses. É superior à associação de gentamicina e metronidazol em cirurgias intestinais (Morris, 1993) e a cefoxitina, em cirurgias abdominais (Morris,1994). Em relação ao cefepime (este também em dose única), a eficácia nas cirurgias colorretais é semelhante (Zanella et al, 2000). Nas cirurgias ginecológicas, biliares e cardiovasculares, a eficácia de sua administração em dose única é similar a cefazolina em múltiplas doses (Hemsell et al, 1984; Kellum et al, 1984; Soteriu et al, 1989). Nas cirurgias mamárias, observou-se menor incidência de infecção pós-operatória quando comparado a ceftazidima (Thomas et al, 1999). Nas cirurgias ortopédicas sua eficácia é semelhante à da cefuroxima (Meyer,1984).
Na profilaxia de infecção após trauma penetrante, a administração precoce (dentro de 2 horas) de ceftriaxona 2 g em dose única tem eficácia semelhante ao uso da cefoxitina na dose de 2 g, 3 vezes ao dia por 3 dias associado a um menor custo de tratamento (Schmidt-Matthiesen et al, 1999).
A ceftriaxona em uma única dose é eficaz para o tratamento da gonorréia com resultados de erradicação da bactéria que variam de 98 a 100% (Handsfield et al, 1994; Jones et al,1991). Sua eficácia em dose única no tratamento do cancróide é similar à azitromicina (Martin et al, 1994). Sua associação com doxicilina é tão eficaz quanto a associação clindamicina e ciprofloxacino no tratamento da doença inflamatória pélvica (Arrendondo et al, 1997).
No tratamento da Doença de Lyme mostra-se superior à penicilina e pode ser considerada droga de escolha (Dattwyler et al, 1987, 1988 e 1997).
No tratamento das celulites, sua eficácia é comparável a cefazolina (Goldstein et al, 1984).
Referências Bibliográficas:
1. Ariffin H, Arasu A, Mahfuzah M et al: Single-daily ceftriaxone plus amikacin versus thrice-daily ceftazidime plus amikacin as empirical treatment of febrile neutropenia in children with cancer. J Paediatr Child Health 2001: 37:38-43.
2. Arrendondo JL, Diaz V, Gaitan H et al: Oral clindamycin and ciprofloxacin versus intramuscular ceftriaxone and oral doxycycline in the treatment of mild-to-moderate pelvic inflammatory disease in outpatients. Clin Infect Dis 1997; 24:170-178.
3. Barnett E, Teele D, Klein J et al: Comparison of ceftriaxone and trimethoprim-sulfamethoxazole for acute otitis media. Pediatrics 1997; 99:23-28.
4. Brogden RN & Ward A: Ceftriaxone: a reappraisal of its antibacterial activity and pharmacokinetic properties, and an update on its therapeutic use with particular reference to once-daily administration. Drugs 1988; 35:604-645.
5. Cohen R, Navel M, Grunberg J et al: One dose ceftriaxone vs ten days of amoxicillin/clavulanate therapy for acute otitis media: clinical efficacy and change in nasopharyngeal flora. Pediatr Infect Dis J 1999; 18:403-409.
6. Dattwyler RJ, Halperin JJ, Pass H et al: Ceftriaxone as effective therapy in refractory Lyme disease. J Infect Dis 1987; 155:1322-1325.
7. Dattwyler RJ, Halperin JJ, Volkman DJ et al: Treatment of late Lyme borreliosis - randomised comparison of ceftriaxone and penicillin. Lancet 1988; 1:1191-1194.
8. Dattwyler RJ, Luft BJ, Kunkel MJ et al: Ceftriaxone compared with doxycycline for the treatment of acute disseminated lyme disease. N Engl J Med 1997; 337:289-294.
9. Feigin RD, McCracken GH & Klein JO: Diagnosis and management of meningitis. Pediatr Infect Dis J 1992; 11:785-814.
10. Garber GE, Auger P, Chan RMT et al: A multicenter, open comparative study of parenteral cefotaxime and ceftriaxone in the treatment of nosocomial lower respiratory tract infections. Diagn Microbiol Infect Dis 1992; 15:85-88.
11. Ghosen V, Chamali R, Bar-Moshe O et al: Clinical study of Rocephin(R), a 3rd generation cephalosporin in various septicaemias. Chemotherapy 1981; 27(suppl 1):100-103.
12. Girgis NI, Abu El Ella AH, Farid Z et al: Ceftriaxone alone compared to ampicillin and chloramphenicol in the treatment of bacterial meningitis. Chemotherapy 1988; 34:16-20.
13. Goldstein NH, Topiel MS, Ehrlich A et al: A comparative study of ceftriaxone vs cefazolin in the treatment of cellulitis. Curr Ther Res 1984; 36:653-657.
14. Gomez-Jimenez J, Ribera E, Gasser I et al: Randomized trial comparing ceftriaxone with cefonicid for treatment of spontaneous bacterial peritonitis in cirrhotic patients. Antimicrob Agents Chemother 1993; 37:1587-1592.
15. Grossman RF, Campbell DA, Landis SJ et al: Treatment of community- acquired pneumonia in the elderly: the role of cefepime, a fouth- generation cephalosporin. J Antimicrob Chemother 1999; 43:549-554.
16. Handsfield HH, Dalu ZA, Martin DH et al: Multicenter trial of single-dose azithromycin vs ceftriaxone in the treatment of uncomplicated gonorrhea. Sex Transm Dis 1994; 21:107-111.
17. Hemsell DL, Menon MO & Friedman AJ: Ceftriaxone or cefazolin prophylaxis for the prevention of infection after vaginal hysterectomy. Am J Surg 1984; 148(Suppl 4a):22-26.
18. Hoepelman IM, Rozenberg-Arska M & Verhoef J: Comparison of once daily ceftriaxone with gentamicin plus cefuroxime for treatment of serious bacterial infections. Lancet 1988; 1:1305-1309.
19. Iravani A & Richard GA: Single-dose ceftriaxone versus multiple-dose trimethoprim-sulfamethoxazole in the treatment of acute urinary tract infections. Antimicrob Agents Chemother 1985; 27:158-161.
20. Jones RB, Mogabgab WJ, McCormack WM et al: Randomized comparison of cefotaxime and ceftriaxone in patients with uncomplicated gonorrhea. Clin Ther 1991; 13:550-556.
21. Keller R & Humair L: Treatment of severe lower respiratory tract infections with ceftriaxone (Ro 13-9904): a pilot study. Chemotherapy 1981; 27(suppl 1):93-99.
22. Kellum JM Jr, Gargano S, Gorbach SL et al: Antibiotic prophylaxis in high-risk biliary operations: multicenter trial of single preoperative ceftriaxone versus multidose cefazolin. Am J Surg 1984; 148(Suppl 4a):15-18.
23. Komoroski EM, Lensing SY, Portilla MG et al: Single-dose intramuscular ceftriaxone for the treatment of uncomplicated cystitis in children and adolescents. Curr Ther Res 1999; 60(11):580-594.
24. Leibovitz E, Janco J, Piglansky L et al: Oral ciprofloxacin vs. intramuscular ceftriaxone as empiric treatment of acute invasive diarrhea in children. Pediatr Infect Dis 2000; 19(11):1060-1067.
25. Mangi RJ, Peccerillo, Ryan J et al: Cefoperazone versus ceftriaxone monotherapy on nosocomial pneumonia. Diagn Microbiol Infect Dis 1992; 15:441-447.
26. Martin DH, Sargent SJ, Wendel GD et al: Comparison of azithromycin and ceftriaxone for the treatment of chancroid. Clin Infect Dis 1995; 21:409-414.
27. Menichetti F, Del Favero A, Bucaneve G et al: Ceftriaxone versus aztreonam plus cefazolin for infections in cancer patients with adequate neutrophil counts. Infection 1990; 18:166-169.
28. Meyer JM: Comparative study of ceftriaxone and cefuroxime for perioperative prophylaxis in orthopedic surgery. Am J Surg 1984; 148:27-29.
29. Moosa A & Rubidge CJ: Once daily ceftriaxone vs chloramphenicol for treatment of typhoid fever in children. Pediatr Infect Dis J 1989; 8:696-699.
30. Morris WT: Ceftriaxone is more effective than gentamicin/metronidazole prophylaxis in reducing wound and urinary tract infections after bowel operations: results of a controlled, randomized, blind critical trial. Dis Colon Rectum 1993; 36:826-833.
31. Morris WT: Effectiveness of ceftriaxone versus cefoxitin in reducing chest and wound infections after upper abdominal operations. Am J Surg 1994; 167:391-395.
32. Peltola H, Anttila M, Renkonen OV et al: Randomised comparison of chloramphenicol, ampicillin, cefotaxime, and ceftriaxone for childhood bacterial meningitis. Lancet 1989; 1:1281-1287.
33. Rascio N, Marseglia GL & Ugazio AG: The treatment of pneumonia in children: ceftriaxone v amoxicillin plus tobramycin--an open trial. Clin Trials J 1985; 22:401-404.
34. Rossini F, Pioltelli P, Bolis S et al: Ceftriaxone/amikacin vs ceftazidime/amikacin as empirical therapy for fever in patients with haematological malignancy and severe granulocytopenia. Clin Drug Invest 1998; 15(5):425-433.
35. Saez-Llorens X & O'Ryan M: Cefepime in the empiric treatment of meningitis in children. Pediatr Infect Dis J 2001; 20(3):356-361.
36. Schmidt-Matthiesen A, Roding H, Windolf J et al: A prospective, randomized comparison of single- vs multiple-dose antibiotic prophylaxis in penetrating trauma. Chemotherapy 1999; 45:380-391.
37. Soteriou M, Recker F, Geroulanos S et al: Perioperative antibiotic prophylaxis in cardiovascular surgery: a prospective randomized comparative trial of cefazolin versus ceftriaxone. World J Surg 1989; 13:798-802.
38. Stone HH, Mullins RJ, Strom PR et al: Ceftriaxone versus combined gentamicin and clindamycin for polymicrobial surgical sepsis. Am J Surg 1984; 148:30-34.
39. Thomas R, Alvino P, Cortino GR et al: Long-acting versus short-acting cephalosporins for preoperative prophylaxis in breast surgery: a randomized double-blind trial involving 1,766 patients. Chemotherapy 1999; 45:217-223.
40. Varsano I, Frydman M, Amir J et al: Single intramuscular dose of ceftriaxone as compared to 7-day amoxicillin therapy for acute otitis media in children. Chemotherapy 1988; 34:39-46.
41. Wiese G: Treatment of neonatal sepsis with ceftriaxone/gentamicin and with azlocillin/gentamicin: a clinical comparison of efficacy and tolerability. Chemotherapy 1988; 34:158-163.
42. Wing DA, Hendershott CM, Debuque L et al: A randomized trial of three antibiotic regimens for the treatment of pyelonephritis in pregnancy. Obstet Gynecol 1998; 92:249-253.
43. Zanella E, Rulli F & The 230 Study Group: A multicenter randomized trial of prophylaxis with intravenous cefepime + metronidazole or ceftriaxone + metronidazole in colorectal surgery. J Chemother 2000; 12(1):63-71.
3. CARACTERÍSTICAS FARMACOLÓGICAS
Farmacodinâmica
Microbiologia
A atividade bactericida da ceftriaxona se deve à inibição da síntese da parede celular. A ceftriaxona, in vitro, é ativa contra um amplo espectro de microrganismos Gram-positivos e Gram-negativos, sendo altamente estável à maioria das betalactamases, tanto cefalosporinases quanto penicilinases desses microrganismos. A ceftriaxona é normalmente ativa in vitro contra os seguintes microrganismos e suas respectivas infecções:
Aeróbios Gram-positivos:
Staphylococcus aureus (meticilina-sensíveis),
Staphylococci coagulase-negativo,
Streptococcus pyogenes (Beta hemolítico grupo A),
Streptococcus agalactiae (Beta hemolítico grupo B),
Streptococci beta hemolítico (grupo não-A ou B),
Streptococcus viridans.
Streptococcus pneumoniae
Obs: Os estafilococos meticilina-resistentes são resistentes às cefalosporinas, inclusive à ceftriaxona. Em geral, Enterococos faecalis, Enterococos faecium e Listeria monocytogenes são também resistentes.
Aeróbios Gram-negativos:
Acinetobacter lwoffi,
Acinetobacter anitratus (principalmente Acinetobacter baumanii)*,
Aeromonas hydrophila,
Alcaligenes faecalis,
Alcaligenes odorans,
Bactéria Alcaligenes-like,
Borrelia burgdorferi,
Capnocytophaga spp.,
Citrobacter diversus (incluindo C. amalonaticus),
Citrobacter freundii*,
Escherichia coli,
Enterobacter aerogenes*,
Enterobacter cloacae*,
Enterobacter spp. (outros)*,
Haemophilus ducreyi,
Haemophilus influenzae,
Haemophilus parainfluenzae,
Hafnia alvei,
Klebsiella oxytoca,
Klebsiella pneumoniae**,
Moraxella catarrhalis (antiga Branhamella catarrhalis)
Moraxella osloensis,
Moraxella spp. (outras),
Morganella morganii,
Neisseria gonorrhoeae,
Neisseria meningitidis,
Pasteurella multocida,
Plesiomonas shigelloides,
Proteus mirabilis,
Proteus penneri*,
Proteus vulgaris*,
Pseudomonas fluorescens*,
Pseudomonas spp. (outras)*,
Providentia rettgeri*,
Providentia spp. (outras),
Salmonella typhi,
Salmonella spp (não-tifóide),
Serratia marcescens*,
Serratia spp. (outras)*,
Shigella spp.,
Vibrio spp.,
Yersinia enterocolitica,
Yersinia spp. (outras).
*Alguns isolados destas espécies são resistentes à ceftriaxona, principalmente devido à produção de beta lactamase codificada cromossomicamente.
** Alguns isolados destas espécies são resistentes devido à produção de beta-lactamase de espectro ampliado mediada por plasmídio.
Obs: Muitas cepas de microrganismos anteriormente mencionados que apresentam resistência a outros antibióticos, como por exemplo, amino e ureido-penicilina, cefalosporinas mais antigas e aminoglicosídeos, são sensíveis à ceftriaxona. Treponema pallidum é sensível à ceftriaxona in vitro e em experimentação animal. Trabalhos clínicos indicam que tanto a sífilis primária como a secundária respondem bem ao tratamento com ceftriaxona. Com poucas exceções clínicas, isolados de P. aeruginosa são resistentes à ceftriaxona.
Microrganismos anaeróbicos:
Bacteroides spp. (bile sensíveis)*,
Clostridium spp.(exceto C. difficile),
Fusobacterium nucleatum,
Fusobacterium spp (outros),
Gaffkia anaerobica (anteriormente Peptococcus),
Peptostreptococcus spp.
* Alguns isolados desta espécie são resistentes devido a produção de beta-lactamase.
Obs: Muitas cepas de Bacteroides spp. produtoras de beta-lactamases (especialmente B. fragillis) são resistentes. Clostridium difficile é resistente.
A sensibilidade à ceftriaxona pode ser determinada por meio do teste de difusão com disco ou do teste de diluição com ágar ou caldo usando técnicas padronizadas para testes de sensibilidade como as recomendadas pelo National Committee for Clinical Laboratory Standards (NCCLS).
O NCCLS fornece os seguintes parâmetros para a ceftriaxona:
Teste de sensibilidade por diluição (concentrações inibitórias em mg/L): sensível = 8 mg/L; moderadamente sensível 16 - 32 mg/L; resistentes = 64 mg/L.
Teste de sensibilidade por difusão usando disco com 30 mcg de ceftriaxona (diâmetro da zona de inibição em mm): sensível = 21 mm, moderadamente sensível = 20 - 14 mm, resistentes = 13 mm.
Os microrganismos devem ser testados com os discos de ceftriaxona uma vez que ficou demonstrado in vitro, que a ceftriaxona é ativa contra certas cepas que se mostraram resistentes em discos da classe cefalosporina.
Quando as normas recomendadas pelo NCCLS não estão disponíveis, pode-se utilizar outras normas bem padronizadas de sensibilidade e interpretação dos testes.
Farmacocinética
A farmacocinética da ceftriaxona não é linear e todos os parâmetros farmacocinéticos básicos, exceto a meia vida de eliminação, são dependentes da dose se baseados nas concentrações totais do fármaco, aumentando menos do que proporcionalmente com a dose. A não linearidade é devida à saturação da ligação com as proteínas plasmáticas e é observada, portanto, para a ceftriaxona plasmática total, mas não para a ceftriaxona livre (não ligada).
Absorção
A concentração plasmática máxima depois de dose única de 1 g IM é de cerca de 81 mg/L e é alcançada em 2 - 3 horas após administração. As áreas sob as curvas de concentração plasmática x tempo, após administração IM e IV, são equivalentes. Isto significa que a biodisponibilidade da ceftriaxona após administração IM é de 100%.
Distribuição
O volume de distribuição da ceftriaxona é de 7 a 12 litros. A ceftriaxona mostrou excelente penetração tissular e nos líquidos orgânicos após dose de 1 - 2 g. Alcança concentrações bem acima da concentração inibitória mínima contra a maioria dos patógenos responsáveis pela infecção e é detectável por mais de 24 horas em mais de 60 tecidos ou líquidos orgânicos, incluindo pulmões, coração, fígado e vias biliares, amígdalas, ouvido médio, mucosa nasal, ossos e fluidos cérebro-espinhal, pleural, prostático e sinovial.
Na administração intravenosa, a ceftriaxona difunde-se rapidamente para o líquido intersticial, onde a concentração bactericida contra organismos sensíveis é mantida por 24 horas.
Ligação proteica
A ceftriaxona liga-se de modo reversível à albumina. A ligação com proteínas plasmáticas é aproximadamente 95% em concentrações plasmáticas menores que 100 mg/L. Essa ligação é saturável e a porção ligada diminui com o aumento da concentração (até 85% em concentrações de 300 mg/L).
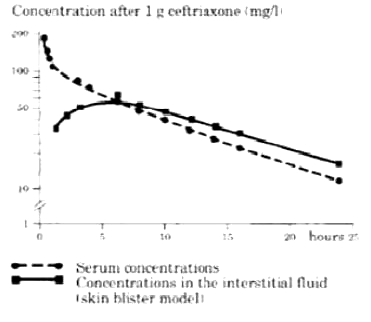
Penetração em tecidos específicos
A ceftriaxona atravessa meninges e essa penetração é maior em meninges inflamadas. A média das concentrações de pico de ceftriaxona no líquido cefalorraquidiano (LCR) reportada corresponde a até 25% dos níveis plasmáticos em pacientes com meningite bacteriana comparada com 2% de níveis plasmáticos em pacientes com meninges não inflamadas.
A ceftriaxona atravessa a placenta e é excretada pelo leite em baixas concentrações.
Metabolização
A ceftriaxona não é metabolizada sistemicamente, mas convertida a metabólitos microbiologicamente inativos pela flora intestinal.
Eliminação
A depuração total do plasma é 10 - 22 mL/min. A depuração renal é 5 - 12 mL/min.
Em adultos, cerca de 50 - 60% de ceftriaxona é excretada sob a forma inalterada na urina, enquanto 40 - 50% são excretados sob a forma inalterada na bile. A meia-vida de eliminação em adultos sadios é de aproximadamente 8 horas.
Farmacocinética em situações clínicas especiais
Crianças: a meia-vida da ceftriaxona é prolongada em neonatos. Em pacientes desde o nascimento até 14 dias de idade, os níveis de ceftriaxona livre podem ser aumentados por fatores como a filtração glomerular reduzida e a ligação proteica alterada. Durante a infância, a meia-vida é menor que em neonatos ou adultos. A depuração plasmática e o volume de distribuição da ceftriaxona total são maiores em neonatos, lactentes e crianças do que em adultos.
Idosos: em indivíduos idosos, com mais de 75 anos, a média da meia-vida de eliminação é cerca de 2 a 3 vezes mais longa que em pacientes adultos.
Insuficiência renal ou hepática: em pacientes com insuficiência renal ou hepática, a farmacocinética da ceftriaxona é minimamente alterada, sendo a meia-vida de eliminação apenas discretamente aumentada (menos que duas vezes), mesmo em pacientes com insuficiência renal grave. O modesto aumento na meia-vida em pacientes com insuficiência renal é devido ao aumento compensatório na depuração não renal, originado por uma redução na ligação proteica e por aumento correspondente na depuração não renal da ceftriaxona total.
Em pacientes com insuficiência hepática, a meia-vida de eliminação da ceftriaxona não é aumentada, por causa de um aumento compensatório na depuração renal. Isto ocorre também por causa de um aumento na fração de ceftriaxona livre no plasma, que contribuiu para o aumento paradoxal observado na depuração de ceftriaxona total, paralelamente a um aumento do volume de distribuição.
4. CONTRAINDICAÇÕES
Hipersensibilidade: este medicamento é contraindicado a pacientes com conhecida hipersensibilidade à ceftriaxona, a qualquer um dos excipientes da formulação ou a qualquer outro cefalosporínico. Pacientes com histórico de reações de hipersensibilidade à penicilina e outros agentes betalactâmicos podem apresentar maior risco de hipersensibilidade à ceftriaxona (vide item 5. ADVERTÊNCIAS E PRECAUÇÕES - Hipersensibilidade).
Lidocaína: contraindicações à lidocaína devem ser excluídas antes da administração de injeções intramusculares de ceftriaxona, nas quais a solução de lidocaína deve ser utilizada como solvente. Favor consultar as contraindicações descritas na bula da lidocaína. Soluções de ceftriaxona que contém lidocaína nunca devem ser administradas por via intravenosa.
Neonatos prematuros: ceftriaxona sódica é contraindicada a neonatos prematuros com idade pós-menstrual (idade corrigida) de até 41 semanas (idade gestacional + idade cronológica).
Recém-nascidos com hiperbilirrubinemia: Recém-nascidos com hiperbilirrubinemia não devem ser tratados com ceftriaxona. Estudos in vitro mostraram que a ceftriaxona pode deslocar a bilirrubina de sua ligação com a albumina sérica, levando a um possível risco de encefalopatia bilirrubínica nesses pacientes.
Neonatos e soluções intravenosas que contém cálcio: A ceftriaxona sódica é contraindicada a neonatos (≤ 28 dias) caso eles requeiram (ou possam requerer) tratamento com soluções IV que contêm cálcio, incluindo infusão contínua de cálcio como a nutrição parenteral, por causa do risco de precipitação de ceftriaxona cálcica (vide itens 8. POSOLOGIA E MODO DE USAR, 6.INTERAÇÕES MEDICAMENTOSAS e 9. REAÇÕES ADVERSAS - Interação com cálcio).
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
5. ADVERTÊNCIAS E PRECAUÇÕES
Hipersensibilidade: assim como para todos os agentes antibacterianos betalactâmicos, reações de hipersensibilidade sérias e, ocasionalmente, fatais foram reportadas em pacientes tratados com ceftriaxona sódica (vide item 9. REAÇÕES ADVERSAS). No caso de reações de hipersensibilidade graves, o tratamento com ceftriaxona sódica deve ser descontinuado imediatamente e medidas de emergência adequadas devem ser iniciadas. Antes do início do tratamento, deve-se concluir se o paciente apresenta histórico de reações de hipersensibilidade à ceftriaxona, outros cefalosporínicos ou qualquer outro tipo de agente betalactâmico. Deve-se tomar precauções, caso ceftriaxona sódica seja administrada em pacientes com histórico de hipersensibilidade a outros agentes betalactâmicos.
Anemia hemolítica: anemia hemolítica imune mediada foi observada em pacientes que receberam antibacterianos da classe das cefalosporinas, incluindo ceftriaxona sódica. Casos graves de anemia hemolítica, incluindo óbitos, foram relatados durante o tratamento em adultos e crianças. Caso um paciente desenvolva anemia durante o uso de ceftriaxona, o diagnóstico de uma anemia associada à cefalosporina deve ser considerado e o uso da ceftriaxona interrompido até que a etiologia seja determinada.
Diarreia associada ao Clostridium difficile (CDAD): CDAD foi relatada com o uso de quase todos os agentes antibacterianos, incluindo ceftriaxona sódica, e pode variar na gravidade, de diarreia leve à colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon, levando a um crescimento exacerbado do C. difficile.
C. difficile produz toxinas A e B, as quais contribuem para o desenvolvimento de CDAD. Cepas de C. difficile hiperprodutoras de toxina causam aumento da morbidade e mortalidade, pois estas infecções podem ser refratárias à terapia antimicrobiana, podendo requerer colectomia. CDAD deve ser considerada em todos os pacientes que apresentarem diarreia após uso de antibióticos. É necessário histórico médico cuidadoso porque já foi relatada a ocorrência de CDAD mais de dois meses após a administração de agentes antibacterianos.
Caso haja suspeita de CDAD ou o diagnóstico seja confirmado, o antibiótico em uso não específico contra C. difficile talvez necessite ser descontinuado. O manejo adequado de líquidos e eletrólitos, suplementação protéica, tratamento antibiótico para C. difficile e a avaliação cirúrgica devem ser instituídos.
Superinfecções: superinfecções com os microrganismos sensíveis podem ocorrer como com outros agentes antibacterianos.
Precipitados de ceftriaxona cálcica: precipitados de ceftriaxona cálcica na vesícula biliar foram observados durante exames ultrassonográficos em pacientes que, particularmente, estavam recebendo doses de ceftriaxona iguais ou superiores a 1 g/dia. A probabilidade de surgimento desses precipitados, aparentemente, é maior em pacientes pediátricos. Os precipitados desaparecem após descontinuação do tratamento com ceftriaxona sódica e são raramente sintomáticos. Em casos sintomáticos, o gerenciamento não cirúrgico conservador é recomendado e a descontinuação do tratamento com ceftriaxona sódica deve ser considerada pelo médico com base na avaliação individual do risco-benefício.
À luz da evidência científica atual, não foram observados casos de precipitações intravasculares em pacientes, exceto em recém-nascidos tratados com ceftriaxona e soluções ou produtos que contenham cálcio. No entanto, a ceftriaxona sódica não deve ser misturada ou administrada simultaneamente com soluções ou produtos que contenham cálcio, a qualquer paciente, mesmo por diferentes cateteres ou acessos venosos para infusão (vide itens 6. INTERAÇÕES MEDICAMENTOSAS e 9. REAÇÕES ADVERSAS).
Pancreatite: casos de pancreatite, possivelmente de etiologia biliar obstrutiva, foram raramente relatados em pacientes tratados com ceftriaxona sódica. A maior parte desses pacientes apresentava fatores de risco para estase/aglutinação biliar, como tratamento prévio intenso, doença grave e nutrição parenteral total. O papel de fator desencadeante ou de cofator de ceftriaxona sódica relacionado à precipitação biliar não pode ser descartado.
Monitoramento hematológico: durante tratamentos prolongados, hemograma completo deve ser feito regularmente.
O diluente de ceftriaxona sódica IM, composto de uma solução de lidocaína, nunca deve ser administrado na veia. Desta forma, sempre utilize ceftriaxona sódica IM somente por via intramuscular, nunca por via intravenosa.
Gravidez e lactação
Categoria de risco na gravidez: B. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Informe ao seu médico ou cirurgião-dentista se ocorrer gravidez ou iniciar amamentação durante o uso deste medicamento.
Apesar dos estudos não demonstrarem defeitos físicos no feto ou indução de mutação genética é necessário cautela nos três primeiros meses de gestação, a não ser em casos absolutamente necessários.
A ceftriaxona atravessa a barreira placentária. A segurança durante a gravidez não foi estabelecida em seres humanos.
Estudos de reprodução em animais não evidenciaram embrio ou fetotoxicidade nem teratogenicidade, ou eventos adversos sobre a fertilidade (tanto masculina quanto feminina), o nascimento ou o desenvolvimento peri ou pós-natal. Em primatas, não foi observada embriotoxicidade ou teratogenicidade.
Como a ceftriaxona sódica é excretada no leite humano em baixas concentrações, é recomendada cautela em mulheres que amamentam.
Uso em idosos
As doses para adultos não precisam ser alteradas para pacientes geriátricos.
Uso em pacientes pediátricos
A segurança e a eficácia de ceftriaxona sódica em recém-nascidos, lactentes e crianças foram estabelecidas para as doses descritas no item 8. POSOLOGIA E MODO DE USAR. Estudos mostraram que a ceftriaxona, assim como outras cefalosporinas, pode deslocar a bilirrubina da albumina sérica. A ceftriaxona sódica não é recomendada para neonatos, especialmente prematuros, que apresentem risco de desenvolver encefalopatia por causa da hiperbilirrubinemia (vide item 4. CONTRAINDICAÇÕES).
Insuficiência hepática e renal
Vide item 8. POSOLOGIA E MODO DE USAR.
Efeitos sobre a capacidade de dirigir e operar máquinas
Durante o tratamento com ceftriaxona sódica, efeitos indesejados podem ocorrer (por exemplo, tontura), os quais podem influenciar a habilidade de dirigir e operar máquinas (vide item 9. REAÇÕES ADVERSAS). Pacientes devem ser cautelosos ao dirigir ou operar máquinas.
Até o momento não há informações de que ceftriaxona possa causar doping.
6. INTERAÇÕES MEDICAMENTOSAS
Até o momento, não se observaram quaisquer alterações da função renal após administração simultânea de doses elevadas de ceftriaxona sódica e potentes diuréticos, como a furosemida.
Há evidências conflitantes sobre o potencial aumento na toxicidade renal dos aminoglicosídeos, quando administrados com cefalosporinas. O monitoramento dos níveis de aminoglicosídeos e da função renal descritos na prática clínica devem ser rigorosamente cumpridos, quando houver administração em combinação com ceftriaxona sódica.
A ceftriaxona sódica não apresentou efeito similar ao provocado pelo dissulfiram após administração de álcool.
A ceftriaxona não contém o radical N-metiltiotetrazol, que está associado a uma possível intolerância ao álcool e a sangramentos observados com outras cefalosporinas.
A probenicida não tem influência sobre a eliminação de ceftriaxona sódica.
Em estudos in vitro, efeitos antagônicos foram observados com o uso combinado de cloranfenicol e ceftriaxona.
Diluentes que contêm cálcio, como as soluções de Ringer ou Hartmann, não devem ser utilizados para a reconstituição de ceftriaxona sódica ou para diluições posteriores de soluções reconstituídas para administração IV, pois pode ocorrer a formação de precipitado. A precipitação de ceftriaxona cálcica também é possível quando a ceftriaxona sódica é misturada com soluções que contêm cálcio no mesmo acesso de administração IV. A ceftriaxona sódica não deve ser administrada simultaneamente com soluções IV que contêm cálcio, inclusive infusões contínuas que contêm cálcio tais como as de nutrição parenteral, através de equipo em Y.
No entanto, em outros pacientes, exceto em recém-nascidos, ceftriaxona sódica e soluções que contenham cálcio podem ser administradas sequencialmente, se as linhas de infusão forem bem lavadas com um líquido compatível. Em estudos in vitro que utilizaram plasma adulto e neonatal do sangue do cordão umbilical, foi demonstrado que recém-nascidos apresentam um risco aumentado de precipitação de ceftriaxona cálcica (vide itens 8. POSOLOGIA E MODO DE USAR e 4. CONTRAINDICAÇÕES).
O uso concomitante de ceftriaxona sódica com antagonistas da vitamina K pode aumentar o risco de sangramentos. Os parâmetros de coagulação devem ser monitorados frequentemente e a dose do anticoagulante deve ser ajustada adequadamente durante e após o tratamento com ceftriaxona sódica (vide item 9. REAÇÕES ADVERSAS).
Interações com exames laboratoriais
Em pacientes tratados com ceftriaxona sódica, o teste de Coombs pode se tornar falso positivo. Assim como com outros antibióticos, pode ocorrer resultado falso positivo para galactosemia.
Os métodos não enzimáticos para a determinação de glicose na urina podem fornecer resultados falso-positivos. Por esse motivo, a determinação de glicose na urina durante o tratamento com ceftriaxona sódica deve ser feita por métodos enzimáticos. A presença da ceftriaxona pode falsamente reduzir os valores estimados de glicose no sangue, quando obtidos a partir de alguns sistemas de monitoramento da glicose sanguínea. Favor consultar as informações de uso para cada sistema utilizado. Métodos de análise alternativos devem ser utilizados, se necessário.
7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Conservar em temperatura ambiente (entre 15 e 30°C). Proteger da umidade.
O prazo de validade deste medicamento é de 24 meses.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
As soluções reconstituídas permanecem estáveis física e quimicamente por 6 horas em temperatura ambiente (entre 15°C e 30°C) ou durante até 24 horas sob refrigeração (entre 2° e 8°C). Entretanto, como regra geral, as soluções devem ser utilizadas imediatamente após a preparação e qualquer porção não utilizada dentro dos prazos e condições descritos deve ser desprezada. A coloração da solução reconstituída é levemente amarelada a âmbar, límpida, dependendo da concentração e do tempo de estocagem. Isto não tem qualquer significado quanto à tolerabilidade ou eficácia do medicamento.
Após preparo, manter no refrigerador, entre 2° e 8°C, por até 24 horas ou manter em temperatura ambiente por até 6 horas.
Características do produto:
A ceftriaxona sódica IM é constituída de pó cristalino branco a amarelo alaranjado contido em frasco-ampola de vidro transparente. O medicamento acompanha ampola de diluente contendo cloridrato de lidocaína, sendo uma solução límpida, incolor, isenta de partículas estranhas. Após a reconstituição a solução contendo ceftriaxona é uma solução levemente amarelada a âmbar, límpida, isenta de partículas ou fibras.
A ceftriaxona sódica IM não possui características organolépticas marcantes que permitam sua diferenciação em relação a outros pós e soluções.
Descarte de seringas / materiais perfuro-cortantes
Os seguintes pontos devem ser rigorosamente respeitados quanto ao uso e descarte de seringas e outros materiais perfurocortantes:
· As agulhas e seringas nunca devem ser reaproveitadas.
· Todas as agulhas e seringas utilizadas devem ser colocadas em um recipiente de descarte apropriado, à prova de perfurações.
· Manter o recipiente de descarte fora do alcance das crianças.
· A colocação do recipiente de descarte no lixo doméstico deve ser evitada.
· O descarte do recipiente deve ser realizado de acordo com as exigências locais ou conforme indicado pelo prestador de cuidados de saúde.
Descarte de medicamentos não utilizados e/ou com data de validade vencida
O descarte de medicamentos no meio ambiente deve ser minimizado. Os medicamentos não devem ser descartados no esgoto e o descarte em lixo doméstico deve ser evitado. Utilize o sistema de coleta local estabelecido, se disponível.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
8. POSOLOGIA E MODO DE USAR
Adultos e crianças acima de 12 anos: A dose usual é de 1 - 2 g de ceftriaxona sódica em dose única diária (cada 24 horas). Em casos graves ou em infecções causadas por patógenos moderadamente sensíveis, a dose pode ser elevada para 4 g, uma vez ao dia.
Recém-nascidos (abaixo de 14 dias): Dose única diária de 20 - 50 mg/kg. Não ultrapassar 50 mg/kg. A ceftriaxona sódica
é contraindicada a neonatos prematuros com idade pós-menstrual (idade gestacional + idade cronológica) de até 41 semanas (vide item 4. CONTRAINDICAÇÕES). A ceftriaxona sódica também é contraindicada a recém-nascidos (≤ 28 dias) caso eles requeiram (ou possam requerer) tratamento com soluções IV que contêm cálcio, incluindo infusão de cálcio contínua como a nutrição parenteral, devido ao risco de precipitação de ceftriaxona cálcica (vide item 4. CONTRAINDICAÇÕES).
Recém-nascidos, lactentes e crianças (15 dias até 12 anos): Dose única diária de 20 - 80 mg/kg. Para crianças de 50 kg ou mais deve ser utilizada a posologia de adultos.
Pacientes idosos: As doses para adultos não precisam ser alteradas para pacientes idosos, desde que o paciente não apresente insuficiência renal e hepática graves.
Duração do tratamento: O tempo de tratamento varia de acordo com a evolução da doença. Como se recomenda na antibioticoterapia em geral, a administração de ceftriaxona sódica deve ser mantida durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obterem-se evidências de erradicação da bactéria.
Terapêutica associada: Tem sido demonstrado, em condições experimentais, um sinergismo entre ceftriaxona e aminoglicosídeos, para muitos bacilos Gram-negativos. Embora não se possa prever sempre um aumento de atividade com essa associação, este sinergismo deve ser considerado nas infecções graves com risco de morte causadas por microrganimos, como Pseudomonas aeruginosa. Por causa da incompatibilidade química entre a ceftriaxona sódica e aminoglicosídeos, esses medicamentos devem ser administrados separadamente, nas doses recomendadas. A incompatibilidade química também foi observada na administração intravenosa da ansacrina, vancomicina e fluconazol com ceftriaxona sódica.
Instruções posológicas especiais
Meningite: na meningite bacteriana de lactentes e crianças deve-se iniciar o tratamento com 100 mg/kg em dose única diária (dose máxima de 4 g). Logo que o germe responsável tenha sido identificado e sua sensibilidade determinada, pode-se reduzir a posologia. Os melhores resultados foram obtidos com os seguintes tempos de tratamento:

Borreliose de Lyme (doença de Lyme): a dose preconizada é de 50 mg/kg até o total de 2 g em crianças e adultos, durante 14 dias, em dose única diária.
Gonorreia: para o tratamento da gonorreia causada por cepas produtoras e não produtoras de penicilinase, recomenda-se uma dose única intramuscular de 250 mg.
Profilaxia no perioperatório: para prevenir infecção pós-operatória em cirurgia contaminada ou potencialmente contaminada, recomenda-se dose única de 1 a 2 g de ceftriaxona sódica 30 a 90 minutos antes da cirurgia. Em cirurgia colorretal, a administração de ceftriaxona sódica com ou sem um derivado 5-nitroimidazólico (por exemplo, ornidazol) mostrou-se eficaz.
Insuficiência hepática e renal: não é necessário diminuir a dose de ceftriaxona sódica nos pacientes com insuficiência hepática, desde que a função renal não esteja prejudicada. Somente nos casos de insuficiência renal pré-terminal (depuração de creatinina < 10 mL/min), a dose de ceftriaxona sódica não deve ser superior a 2 g/dia.
Não é necessário diminuir a dose nos pacientes com insuficiência renal, desde que a função hepática não esteja prejudicada. A ceftriaxona não é removida por diálise peritoneal ou hemodiálise. Pacientes submetidos à diálise não necessitam de dose suplementar após o procedimento.
Insuficiência hepática e renal graves: no caso de insuficiência hepática e renal graves e concomitantes, recomendasse realizar o monitoramento clínico da segurança e eficácia do medicamento.
Modo de usar
Administração intramuscular: dissolver ceftriaxona sódica IM 500 mg em 2 mL e a ceftriaxona sódica IM 1g em 3,5 mL de uma solução de lidocaína a 1% e injetar profundamente na região glútea ou em outro músculo relativamente grande. Recomenda-se não injetar mais do que 1 g em um sítio de administração.
O diluente de ceftriaxona sódica IM, composto de uma solução de lidocaína, nunca deve ser administrado por via intravenosa (vide item 4. CONTRAINDICAÇÕES). Desta forma, sempre utilize ceftriaxona sódica IM somente por via intramuscular, nunca por via intravenosa.
Incompatibilidades
Diluentes que contêm cálcio, como as soluções de Ringer ou Hartmann, não devem ser utilizados para a reconstituição de ceftriaxona sódica ou para diluições posteriores de soluções reconstituídas para administração IV, pois pode ocorrer formação de precipitado. A precipitação de ceftriaxona cálcica também pode ocorrer quando ceftriaxona sódica é misturada com soluções que contêm cálcio no mesmo equipo de administração IV. ceftriaxona sódica não deve ser administrado simultaneamente com soluções IV que contêm cálcio, inclusive infusões contínuas que contêm cálcio tais como as de nutrição parenteral, através de equipo em Y. No entanto, em outros pacientes, exceto em recém-nascidos, ceftriaxona sódica e soluções que contenham cálcio podem ser administrados sequencialmente, entre as infusões, se as linhas de infusão forem bem lavadas com um líquido compatível.
Até o momento não houve relatos de interação entre ceftriaxona e produtos orais que contêm cálcio ou interação entre ceftriaxona intramuscular e produtos que contêm cálcio (IV ou oral).
Baseado em artigos da literatura, ceftriaxona não deve ser diluída em frasco com outros antimicrobianos tais como, amsacrina, vancomicina, fluconazol e aminoglicosídeos.
O volume final do medicamento preparado, segue abaixo:

A dose de substância ativa por kg de peso corpóreo, segue abaixo:

9. REAÇÕES ADVERSAS
Estudos clínicos
As reações adversas mais frequentemente reportadas para ceftriaxona são eosinofilia, leucopenia, trombocitopenia, diarreia, erupção cutânea e aumento das enzimas hepáticas. Os dados para determinar a frequência das reações adversas de ceftriaxona foram obtidos de estudos clínicos.
Reação comum ( > 1/100 e < 1/10): eosinofilia, leucopenia, trombocitopenia, diarreia, fezes amolecidas, aumento das enzimas hepáticas e erupção cutânea.
Reação incomum ( > 1/1.000 e < 1/100): infecção fúngica no trato genital, granulocitopenia, anemia, coagulopatia, cefaleia, tontura, náusea, vômito, prurido, flebite, dor no local da administração, febre e aumento da creatinina sérica.
Reação rara ( > 1/10.000 e < 1/1.000): colite pseudomembranosa, broncoespasmo, urticária, hematúria, glicosúria, edema e calafrios.
Pós-comercialização
As reações adversas a seguir foram identificadas durante o período de pós-comercialização de ceftriaxona. Essas reações foram reportadas por uma população de tamanho incerto, portanto, não é possível estimar com segurança sua frequência e/ou estabelecer uma relação causal com a exposição ao fármaco.
Problemas gastrintestinais: pancreatite, estomatite e glossite.
Alterações hematológicas: casos isolados de agranulocitose ( < 500/mm3) foram relatados, a maior parte deles após 10 dias de tratamento e doses totais de 20 g ou mais.
Reações cutâneas: pustulose exantemática generalizada aguda (PEGA) e casos isolados de graves reações cutâneas, como eritema multiforme, síndrome de Stevens Johnson ou síndrome de Lyell / necrólise epidérmica tóxica.
Alterações no sistema nervoso: convulsão.
Infecções e infestações: superinfecção.
Outros efeitos colaterais raros: sedimento sintomático de ceftriaxona cálcica na vesícula biliar (litíase biliar), icterícia,kernicterus, oligúria, reações anafiláticas e anafilactoides.
Interação com cálcio: dois estudos in vitro, um utilizando plasma de adultos e outro plasma neonatal do sangue do cordão umbilical, foram realizados para avaliar a interação de ceftriaxona e cálcio. Concentrações de ceftriaxona de até 1 mM (em excesso de concentrações obtidas in vivo, após administração de 2 g de ceftriaxona em perfusão durante 30 minutos) foram usadas em combinação com concentrações de cálcio de até 12 mM (48 mg/dL). A recuperação de ceftriaxona do plasma foi reduzida com concentrações de cálcio de 6 mM (24 mg/dL) ou superior no plasma de adultos ou 4 mM (16 mg/dL) ou superior no plasma neonatal. Isso pode ser reflexo da precipitação de ceftriaxona cálcica.
Em recém-nascidos que receberam ceftriaxona e soluções que continham cálcio, foi relatado um pequeno número de casos fatais, nos quais um material cristalino foi observado nos pulmões e rins durante a autópsia. Em alguns desses casos, a mesma linha de infusão intravenosa foi usada para ceftriaxona e para as soluções contendo cálcio e, em algumas destas vias de infusão, foi observado um precipitado. Pelo menos uma fatalidade foi relatada com um recém-nascido no qual a ceftriaxona e soluções que continham cálcio foram administradas em diferentes momentos, em vias de infusão diferentes; e nenhum material cristalino foi observado na autópsia desse neonato. Não houve relatos semelhantes em pacientes não neonatos.
Foram relatados casos de precipitação de ceftriaxona no trato urinário, principalmente em crianças que foram tratadas com altas doses (por exemplo, doses maiores ou iguais a 80 mg/kg/dia ou com dose total excedendo 10 g) e que apresentavam outros fatores de risco (por exemplo, desidratação, confinamento a cama). Esse evento pode ser assintomático ou sintomático, e pode levar à obstrução da uretra e insuficiência renal aguda, mas é geralmente reversível com a descontinuação de ceftriaxona.
Efeitos colaterais locais: em raros casos, reações de flebite ocorrem após administração intravenosa. Essas podem ser minimizadas pela prática de injeção lenta do produto (2 - 4 min).
Investigações: resultados falso positivos para os testes de Coombs, galactosemia e métodos não enzimáticos para determinação da glicose.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária - NOTIVISA, disponível em http://portal.anvisa.gov.br/notivisa, ou para a Vigilância Sanitária Estadual ou Municipal.
10. SUPERDOSE
Em casos de superdose, a concentração da droga não deve ser reduzida por hemodiálise ou diálise peritoneal. Não há antídoto específico. O tratamento deve ser sintomático.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
Dizeres legais.
M.S.: 1.0043.0710
VENDA SOB PRESCRIÇÃO MÉDICA. SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Esta bula foi atualizada conforme Bula Padrão aprovada pela ANVISA em 10/06/2015.
CEFTRIAXONA (GENÉRICO)
EUROFARMA
IM
ceftriaxona
Antibiótico.
USO ADULTO E PEDIÁTRICO.
Apresentações.
Solução injetável I.M.: caixa com 1 frasco-ampola contendo pó estéril equivalente a 500 mg e 1 g de ceftriaxona. Acompanham ampolas de diluente de 2 ml ou 3,5 ml (lindocaína 1%), respectivamente, para aplicação intramuscular (I.M.). Cada 1 ml de solvente para injeção intramuscular contém 10,66 mg de cloridrato de lidocaína, equivalente a 10 mg de cloridrato de lidocaína anidra.
Composição.
O princípio ativo Ceftriaxona (6R, 7R)-7-(Z)-2-(amino-4-tiazolil)-2-[metoxiimino] acetamido-3-[(2,5-diidro-6-hidroxi-2-metil-5-oxo-as-triazin-3-il)tio]metil-8-oxo-5-tia-1-azobiciclo [4,2,0]-oct-2-en-2- ácido carboxílico, está presente sob a forma de sal dissódico. CEFTRIAXONA SÓDICA contém aproximadamente 83 mg (3,6 mEq) de sódio por grama de ceftriaxona.
VENDA SOB PRESCRIÇÃO MÉDICA.
Reg. M.S.: 1.0043.0710.
Informações ao paciente.
Ação esperada do medicamento: CEFTRIAXONA SÓDICA é um antibiótico cefalosporínico de amplo espectro e ação prolongada capaz de eliminar uma grande variedade de microrganismos responsáveis por diversos tipos de infecções, desde que estes microrganismos sejam sensíveis à ceftriaxona. Cuidados de armazenamento: conservar em local fresco. Proteger da luz. Após reconstituição, a solução obtida permanece estável físico e quimicamente por 6 horas a temperatura ambiente (entre 15°C e 30°C) ou por 24 horas sob refrigeração (entre 2°C e 8°C). Entretanto, como regra geral, as soluções devem ser utilizadas imediatamente após a preparação e qualquer porção não utilizada dentro dos prazos e condições descritos deve ser desprezada. A coloração varia de amarelo-pálido a âmbar, dependendo da concentração e do tempo de estocagem; esta particularidade da CEFTRIAXONA SÓDICA não tem qualquer significado quanto a sua tolerabilidade e eficácia. Prazo de validade: desde que observados os devidos cuidados de conservação, o prazo de validade de CEFTRIAXONA SÓDICA é de 24 meses, contados a partir da data de fabricação impressa em sua embalagem externa. NÃO USE MEDICAMENTOS COM O PRAZO DE VALIDADE VENCIDO. Gravidez e lactação: CEFTRIAXONA SÓDICA não deve ser administrada quando houver gravidez suspeita ou confirmada e/ou durante a lactação, a não ser que, a critério médico, os benefícios do tratamento esperados para a mãe superem os riscos potenciais para o feto. Deve-se ter cautela especialmente nos três primeiros meses de gestação. Informe ao seu médico a ocorrência de gravidez na vigência do tratamento ou após o seu término. Apesar da baixa concentração de CEFTRIAXONA SÓDICA encontrada no leite materno, durante o tratamento recomenda-se cuidado especial a pacientes que amamentam. Informe ao seu médico se está amamentando. Cuidados de administração: após reconstituição com a solução diluente apropriada (lidocaína 1%), CEFTRIAXONA SÓDICA deve ser administrada exclusivamente por via intramuscular uma vez que soluções contendo lidocaína nunca devem ser administradas por via intravenosa. Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Interrupção do tratamento: não interrompa o tratamento sem o conhecimento do seu médico; somente o médico poderá avaliar a eficácia da terapia. A interrupção do tratamento pode ocasionar a não obtenção dos resultados esperados. A duração do tratamento varia de acordo com a evolução da doença. Como recomendada na antibioticoterapia em geral, a administração de CEFTRIAXONA SÓDICA deve ser continuada durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obter-se evidências da erradicação da bactéria. Reações adversas: informe ao seu médico o aparecimento de reações desagradáveis. Somados aos efeitos benéficos do tratamento com CEFTRIAXONA SÓDICA é possível a ocorrência de efeitos indesejáveis durante o tratamento, mesmo quando este produto é utilizado corretamente. CEFTRIAXONA SÓDICA é bem tolerada pela maioria dos pacientes. As reações adversas mais comuns são as gastrintestinais como náusea, vômito, diarréia, estomatite e glossite; alterações hematológicas como eosinofilia, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia e reações cutâneas como exantema, prurido e urticária. TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. Ingestão concomitante com outras substâncias: não são conhecidas interações deste medicamento com alimentos e álcool. Entretanto, recomenda-se não ingerir bebidas alcóolicas durante o tratamento. Contra-indicações e precauções: o uso deste medicamento é contra-indicado em caso de hipersensibilidade conhecida a CEFTRIAXONA SÓDICA, antibióticos do grupo das cefalosporinas e penicilinas e/ou demais componentes da formulação. Informe ao seu médico sobre qualquer medicamento que esteja usando, antes do início, ou durante o tratamento. Pacientes que estejam fazendo uso de cloranfenicol não devem utilizar CEFTRIAXONA SÓDICA devido ao efeito antagônico observado in vitro. NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO, PODE SER PERIGOSO PARA A SAÚDE.
Informações técnicas.
Características: CEFTRIAXONA SÓDICA é um antibiótico cefalosporínico de amplo espectro e ação prolongada. Ceftriaxona ou (6R, 7R)-7-(Z)-2-(amino-4-tiazolil)-2-[metoxiimino] acetamido-3-[(2,5-diidro-6-hidroxi-2-metil-5-oxo-as-triazin-3-il)tio]metil-8-oxo-5-tia-1-azobiciclo [4,2,0]-oct-2-en-2-ácido carboxílico está presente sob a forma de sal dissódico. Microbiologia: a atividade bactericida de CEFTRIAXONA SÓDICA é devida à inibição da síntese da parede celular. A CEFTRIAXONA SÓDICA in vitro, é ativa contra um amplo espectro de microrgarnismos Gram-positivos e Gram-negativos, sendo altamente estável à maioria das betalactamases, cefalosporinases e penicilinases desses microrganismos. A CEFTRIAXONA SÓDICA é habitualmente ativa in vitro contra os microrganismos e infecções clínicas (vide Indicações). Aeróbios Gram-Positivos: Staphylococcus aureus (inclusive cepas produtoras de penicilinases), Staphylococcus coagulase-negativo, Streptococcus beta-hemolítico (grupo não-A não-B), Streptococcus pneumoniae, Streptococcus pyogenes (Streptococcus beta hemolítico do grupo A), Streptococcus agalactiae (Streptococcus beta hemolítico do grupo B) e Streptococcus viridans. Obs.: os estafilococos meticilina resistentes são resistentes às cefalosporinas, inclusive à CEFTRIAXONA SÓDICA. Em geral, Enterococcus faecalis, Enterococcus faecium e Listeria monocytogenes são resistentes. Aeróbios Gram-negativos: Acinetobacter lwoffi, Acinetobacter anitratus (principalmente Acinetobacter baumanii), Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, bactéria Alcaligenes-like, Borrelia burgdoferi, Branhamella catarrhalis, Capnocytophaga spp., Citrobacter diversus (incluindo C.i), i*, Escherichia coli, i, i e Enterobacter spp. (outros)*, Haemophillus ducreyi, Haemophillus influenzae, Haemophillus parainfluenzae, Hafnia alvei, Klebsiella oxytoca e Klebsiella pneuymoniae**, Moraxella osloensis, Moraxella spp. (outras) e Moraxella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pastereulla multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri* e Proteus vulgaris, I Providencia spp. e Providencia rettgeri*, Providencia spp. (outras), Salmonella typhi, Salmonella spp. (não tifóide), Serratia marcescens* e Serratia spp. (outras)*, Shigella spp., Vibrio spp., Yersinia enterocolitica e Yersinia spp. (outras). *Alguns isolados destas espécies são resistentes à CEFTRIAXONA SÓDICA principalmente devido à produção de betalactamase codificada cromossomicamente. **Alguns isolados destas espécies são resistentes devido à produção de betalactamase mediada por plasmídio, de espectro ampliado. Obs.: muitas cepas de microrganismos anteriormente mencionados que apresentam resistência a outros antibióticos, como por exemplo amino e ureidopenicilina, cefalosporinas mais antigas e aminoglicosídeos, são sensíveis à CEFTRIAXONA SÓDICA. Treponema pallidum é sensível à CEFTRIAXONA SÓDICA in vitro e em experimentação animal. Trabalhos clínicos (em andamento) indicam que tanto a sífilis primária como a secundária respondem bem ao tratamento com CEFTRIAXONA SÓDICA. Com poucas exceções clínicas, isolados de P. aeruginosa são resistentes à CEFTRIAXONA SÓDICA. Microrganismos anaeróbios: Bacterioides spp. (bile sensíveis)*, Clostridium spp. (exceto C. difiicile), Fusobacterium nucleatum, Fusobacterium spp. (outros), Gaffkia anaeróbica (anteriormente Peptococcus) e Peptostreptococcus ssp. Obs.: muitas cepas de Bacteroides spp., produtoras de betalactamases (especialmente B. fragillis) são resistentes. Clostridium difficili é resistente. *Alguns isolados desta espécie são resistentes à produção de beta-lactamase. A sensibilidade à CEFTRIAXONA SÓDICA pode ser determinada por meio do teste de difusão com disco ou do teste de difusão com ágar ou caldo, usando técnicas padronizadas para testes de sensibilidade como as recomendadas pelo National Comittee for Clinical Laboratory Standards (NCCLS). O NCCLS fornece os seguintes parâmetros para a CEFTRIAXONA SÓDICA: testes de sensibilidade por diluição: sensível < 8mg/L; moderadamente sensível 16-32mg/L, resistentes > 64mg/L. Teste de sensibilidade por difusão usando disco com 30mcg de CEFTRIAXONA SÓDICA: sensível > 21mm, moderadamente sensível 20-14mm, resistente < 13mm. Os microrganismos devem ser testados com os discos de CEFTRIAXONA SÓDICA, uma vez que foi demonstrado in vitro que a CEFTRIAXONA SÓDICA é ativa contra certas cepas que se mostraram resistentes em discos da classe das cefalosporinas. Farmacocinética: a CEFTRIAXONA SÓDICA caracteriza-se por uma meia-vida de eliminação extraordinariamente longa de aproximadamente 8 horas, em adultos sadios. As áreas sob as curvas de concentração plasmática pelo tempo, após administração intramuscular e intravenosa são idênticas, ou seja, a biodisponibilidade da CEFTRIAXONA SÓDICA após administração intramuscular é de 100%. Absorção: a concentração plasmática depois de dose única de 1g I.M. é de cerca de 81mg/L e é alcançado em 2 - 3 horas após a administração. A área sob a curva de concentração plasmática após administração intramuscular é equivalente à intravenosa, indicando a biodisponibilidade de 100 % após administração intramuscular. Distribuição: o volume de distribuição da CEFTRIAXONA SÓDICA é de 7 a 12 L. A CEFTRIAXONA SÓDICA mostrou excelente penetração tecidual, alcançando concentrações acima da Concentração Inibitória Mínima (C.I.M.) contra a maioria dos patógenos responsáveis pela infecção, e são detectáveis por mais de 24 horas em mais de 60 tecidos, incluindo pulmões, coração, fígado e vias biliares, amígdalas, ouvido médio, mucosa nasal, ossos e fluidos cérebro-espinhal, pleural, prostático e sinovial. Ligação protéica: a CEFTRIAXONA SÓDICA liga-se reversivelmente à albumina, diminuindo a ligação com o aumento da concentração. Assim, para uma concentração plasmática < 100mcg/mL, a ligação protéica é de 95%, enquanto para uma concentração de 300mcg/mL, a ligação é de 85%. Devido ao conteúdo mais baixo em albumina, a proporção de ceftriaxona livre no líquido intersticial é proporcionalmente mais alta que no plasma. Passagem para o líquido cefalorraquidiano: a CEFTRIAXONA SÓDICA atravessa as meninges inflamadas de lactente e crianças maiores. O grau de difusão média no líquido cefalorraquidiano (LCR) corresponde a 17% da concentração plasmática nos pacientes com meningite bacteriana e 4% em pacientes com meningite asséptica. Concentrações da CEFTRIAXONA SÓDICA > 1,4mcg/mL foram encontradas no LCR, 24 horas após administração de 50-100mg/kg de CEFTRIAXONA SÓDICA por via intravenosa. Em pacientes adultos com meningite a administração de 50mg/kg produz, em 2 a 24 horas, concentrações no LCR muitas vezes superiores às Concentrações Inibitórias Mínimas (C.I.M.) requeridas pela grande maioria dos microrganismos causadores da meningite. Metabolização: a CEFTRIAXONA SÓDICA não é metabolizada sistematicamente, mas convertida a metabólitos inativos pela microbiota intestinal. Eliminação: a meia-vida de eliminação em adultos sadios é de aproximadamente 8 horas. Em crianças com menos de 8 dias de vida e em adultos com mais de 75 anos, a meia-vida de eliminação é cerca de 2 vezes mais longa. Em adultos cerca de 50 a 60% são excretados na urina de forma inalterada, enquanto 40 a 50% são excretados na bile de forma inalterada. A microbiota intestinal transforma a CEFTRIAXONA SÓDICA em metabólitos microbiologicamente inativos. Nos recém nascidos, a eliminação urinária representa cerca de 70% da dose administrada. Em pacientes com insuficiência renal ou hepática a farmacocinética da CEFTRIAXONA SÓDICA é discretamente alterada, sendo a meia-vida de eliminação levemente aumentada. Se apenas a função renal está prejudicada, há um aumento na eliminação biliar; se, ao contrário, a função hepática está prejudicada, há um aumento na eliminação urinária. O clearence total do plasma é de 10-20mL/min. O clearence renal é de 5-12mL/min.
Indicações.
Infecções causadas por microrganismos sensíveis à CEFTRIAXONA SÓDICA, como por exemplo: sepse; meningite; borreliose de Lyme disseminada (estágios precoces e tardios da doença); infecções intra-abdominais (peritonites, infecções do trato gastrintestinal e biliar); infecções ósseas, articulares, tecidos moles, pele e feridas; infecções em pacientes com mecanismos de defesa comprometidos; infecções renais e do trato urinário; infecções do trato respiratório, particularmente pneumonia e infecções otorrinolaringológicas; infecções genitais, incluindo gonorréia; profilaxia de infecções pós-operatórias.
Contraindicações.
CEFTRIAXONA SÓDICA ESTÁ CONTRA-INDICADA EM PACIENTES COM CONHECIDA HIPERSENSIBILIDADE AOS ANTIBIÓTICOS DO GRUPO DAS CEFALOSPORINAS E OU DEMAIS COMPONENTES DA FORMULAÇÃO. EM PACIENTES HIPERSENSÍVEIS À PENICILINA DEVE-SE CONSIDERAR A POSSIBILIDADE DE REAÇÕES ALÉRGICAS CRUZADAS. CEFTRIAXONA SÓDICA NÃO DEVE SER ADICIONADA A SOLUÇÕES QUE CONTENHAM CÁLCIO COMO A SOLUÇÃO DE HARTMANN OU SOLUÇÕES DE RINGER. BASEADO EM ARTIGOS DE LITERATURA, CEFTRIAXONA SÓDICA É INCOMPATÍVEL COM ASACRINA, VANCOMICINA, FLUCONAZOL E AMINOGLICOSÍDEOS.
Precauções.
COMO OCORRE COM OUTRAS CEFALOSPORINAS, A OCORRÊNCIA DE CHOQUE ANAFILÁTICO NÃO PODE SER AFASTADA, MESMO SEM ANTECEDENTES ALÉRGICOS. A OCORRÊNCIA DE CHOQUE ANAFILÁTICO EXIGE INTERVENÇÃO IMEDIATA. EM CASOS RAROS O EXAME ULTRASONOGRÁFICO DA VESÍCULA BILIAR REVELOU IMAGENS SUGESTIVAS DE SEDIMENTO. ESTES, GERALMENTE APÓS O USO DE DOSES MAIS ALTAS QUE O RECOMENDADO, DESAPARECEM COM A CONCLUSÃO OU DESCONTINUAÇÃO DO TRATAMENTO COM CEFTRIAXONA SÓDICA. RECOMENDA-SE TRATAMENTO CLÍNICO CONSERVADOR MESMO NOS CASOS EM QUE TAIS ACHADOS SE ACOMPANHAM DE SINTOMATOLOGIA DOLOROSA. FOI DESCRITA COLITE PSEUDOMEMBRANOSA COM QUASE TODOS OS AGENTES ANTIBACTERIANOS, INCLUINDO CEFTRIAXONA SÓDICA. PORTANTO É IMPORTANTE CONSIDERAR ESTE DIAGNÓSTICO EM PACIENTES QUE SE APRESENTAM COM DIARRÉIA SUBSEQUENTE À ADMINISTRAÇÃO DE AGENTES ANTIBACTERIANOS. ESTUDOS IN VITRO DEMONSTRARAM QUE CEFTRIAXONA SÓDICA, COMO OUTRAS CEFALOSPORINAS, PODE DESLOCAR BILIRRUBINA DA ALBUMINA SÉRICA. CASOS DE PANCREATITE, POSSIVELMENTE DE ETIOLOGIA POR OBSTRUÇÃO BILIAR FORAM RELATADOS EM PACIENTES QUE UTILIZARAM CEFTRIAXONA SÓDICA. A MAIORIA DOS PACIENTES APRESENTAVAM FATORES DE RISCO PARA ESTASE BILIAR E BARRO BILIAR, POR EXEMPLO, TERAPIA PRINCIPAL ANTERIOR, DOENÇA GRAVE E NUTRIÇÃO PARENTERAL TOTAL. O PAPEL DE FATOR DESENCADEANTE OU DE COFATOR DA CEFTRIAXONA SÓDICA RELACIONADO À PRECIPITAÇÃO BILIAR NÃO PODE SER DESCARTADO. CEFTRIAXONA SÓDICA NÃO É RECOMENDADA PARA NEONATOS, ESPECIALMENTE PREMATUROS QUE APRESENTEM RISCO DE DESENVOLVER ENCEFALOPATIA DEVIDO À HIPERBILIRRUBINEMIA. DURANTE TRATAMENTOS PROLONGADOS, DEVE-SE FAZER CONTROLE REGULAR DO HEMOGRAMA. A INJEÇÃO INTRAMUSCULAR SEM A SOLUÇÃO DILUENTE APROPRIADA (LIDOCAÍNA 1%) É DOLOROSA. USO DURANTE A GRAVIDEZ E LACTAÇÃO: CEFTRIAXONA SÓDICA ATRAVESSA A BARREIRA PLACENTÁRIA. SUA SEGURANÇA DURANTE A GRAVIDEZ NÃO FOI ESTABELECIDA EM SERES HUMANOS. ESTUDOS DE REPRODUÇÃO EM ANIMAIS NÃO EVIDENCIARAM EMBRIO, FETO OU TERATOGENICIDADE, OU EFEITOS ADVERSOS SOBRE A FERTILIDADE (TANTO MASCULINA, QUANTO FEMININA), O NASCIMENTO OU O DESENVOLVIMENTO PERI OU PÓS NATAL. EM PRIMATAS NÃO FOI OBSERVADO EMBRIO OU TERATOGENICIDADE. COMO A CEFTRIAXONA SÓDICA É EXCRETADA NO LEITE EM BAIXAS CONCENTRAÇÕES, DURANTE O TRATAMENTO RECOMENDA-SE CUIDADO ÀS MULHERES QUE AMAMENTAM. EFEITOS SOBRE A HABILIDADE DE DIRIGIR VEÍCULOS E/OU OPERAR MÁQUINAS: NÃO HÁ EVIDÊNCIAS DE QUE CEFTRIAXONA SÓDICA DIMINUA A HABILIDADE DE DIRIGIR VEÍCULOS E/OU OPERAR MÁQUINAS.
Interações medicamentosas.
ATÉ O MOMENTO NÃO FOI OBSERVADA QUALQUER ALTERAÇÃO DA FUNÇÃO RENAL APÓS ADMINISTRAÇÃO SIMULTÂNEA DE DOSES ELEVADAS DE CEFTRIAXONA SÓDICA E POTENTES DIURÉTICOS COMO FUROSEMIDA, EM ALTAS DOSES. NÃO EXISTE TAMBÉM QUALQUER EVIDÊNCIA DE QUE CEFTRIAXONA SÓDICA AUMENTE A TOXICIDADE DOS AMINOGLICOSÍDEOS. CEFTRIAXONA SÓDICA NÃO APRESENTOU EFEITO SIMILAR AO PROVOCADO PELO DISSULFIRAM APÓS ADMINISTRAÇÃO DE ÁLCOOL. A CEFTRIAXONA SÓDICA NÃO CONTÉM O RADICAL N-METILTIOTETRAZOL, QUE ESTÁ ASSOCIADO A UMA POSSÍVEL INTOLERÂNCIA E A SANGRAMENTOS OBSERVADOS COM OUTRAS CEFALOSPORINAS. A PROBENECIDA NÃO TEM INFLUÊNCIA SOBRE A ELIMINAÇÃO DA CEFTRIAXONA SÓDICA. EM ESTUDOS IN VITRO, EFEITOS ANTAGÔNICOS FORAM OBSERVADOS COM O USO COMBINADO DE CLORANFENICOL E CEFTRIAXONA SÓDICA. ALTERAÇÃO NOS EXAMES CLÍNICOS E LABORATORIAIS: NOS PACIENTES TRATADOS COM CEFTRIAXONA SÓDICA O TESTE DE COOMBS PODE RARAMENTE TORNAR-SE FALSO-POSITIVO, ASSIM COMO O TESTE PARA GALACTOSEMIA. OS MÉTODOS NÃO ENZIMÁTICOS PARA DETERMINAÇÃO DE GLICOSE NA URINA PODEM FORNECER RESULTADOS FALSO-POSITIVOS. POR ESSE MOTIVO A DETERMINAÇÃO DE GLICOSE NA URINA DEVE SER FEITA POR MÉTODOS ENZIMÁTICOS.
Posologia e modo de usar.
Adultos e crianças acima de 12 anos: a dose usual é de 1 - 2g de CEFTRIAXONA SÓDICA em dose única diária (cada 24 horas). Em casos graves ou em infecções causadas por patógenos moderadamente sensíveis, a dose pode ser elevada para 4g, uma vez ao dia. Recém-nascidos (abaixo de 14 dias): dose única diária de 20-50mg/kg. Não ultrapassar 50mg/kg devido à imaturidade dos sistemas enzimáticos destes recém-nascidos. Não é necessário diferenciar crianças prematuras de crianças nascidas a termo. Lactentes e crianças (15 dias até 12 anos): dose única diária de 20-80mg/kg. Para crianças com 50 kg ou mais deve ser usada a posologia de adultos. Doses intravenosas maiores ou iguais a 50mg/kg de peso corpóreo devem ser administradas por infusão intravenosa por período de infusão superior a 30 minutos. Pacientes idosos: as doses para adultos não precisam ser alteradas em pacientes geriátricos. Duração do tratamento: a duração do tratamento irá variar de acordo com a evolução da doença. Como se recomenda na antibioticoterapia em geral, a administração de CEFTRIAXONA SÓDICA deve ser continuada durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obter-se evidências da erradicação da bactéria. Terapêutica associada: foi demonstrado, em condições experimentais, um sinergismo entre CEFTRIAXONA SÓDICA e aminoglicosídeos para muitos bacilos Gram-negativos. Embora não se possa prever sempre um aumento de atividade com esta associação, este sinergismo deve ser considerado nas infecções graves com risco de vida causada por Pseudomona aeruginosa. Devido à incompatibilidade física, os medicamentos devem ser administrados separadamente, nas doses recomendadas. Instruções posológicas especiais. Meningite bacteriana: na meningite bacteriana de lactentes e crianças deve-se iniciar o tratamento com 100mg/kg em dose única diária. Logo que o microrganismo responsável tenha sido identificado e sua sensibilidade determinada, pode-se reduzir a posologia. Os melhores resultados foram obtidos com os seguintes tempos de tratamento: Neisseria meningitidis: 4 dias; Haemophilus influenzae: 6 dias; Streptococcus pneumoniae: 7 dias. Gonorréia: para o tratamento da gonorréia causada por cepas produtoras e não-produtoras de penicilinase recomenda-se uma dose única de 250mg. Borreliose de Lyme (doença de Lyme): a dose preconizada é de 50mg/kg até o total de 2 g em crianças e adultos, durante 14 dias, em dose única diária. Profilaxia no pré-operatório: para previnir infecção pós-operatória em cirurgia contaminada ou potencialmente contaminada, recomenda-se 1 a 2 g de CEFTRIAXONA SÓDICA 30 a 90 minutos antes da cirurgia. Em cirurgia colo-retal a administração com ou sem associação de um derivado 5-nitroimidazólico mostrou-se eficaz. Insuficiências hepática e renal: não é necessário diminuir a dose em pacientes com insuficiência renal desde que a função hepática esteja normal. Somente nos casos em que o clearance de creatinina for menor que 10mL por minuto a dose de CEFTRIAXONA SÓDICA não deve ser superior a 2 g/dia. Não é necessário diminuir a dose de CEFTRIAXONA SÓDICA em pacientes com insuficiência hepática desde que a função renal se mantenha normal. Nos casos de insuficiências hepática e renal graves e concomitantes deve-se determinar a concentração plasmática de CEFTRIAXONA SÓDICA a intervalos regulares e a dose deve ser ajustada. Em pacientes sob diálise não há necessidade de doses suplementares após diálise. Entretanto as concentrações séricas devem ser monitoradas, afim de avaliar a necessidade de ajuste na posologia, pois a taxa de eliminação pode ser reduzida nestes pacientes. Administração: após reconstituição com a solução diluente apropriada (lidocaína 1%), CEFTRIAXONA SÓDICA deve ser administrada exclusivamente por via intramuscular uma vez que soluções contendo lidocaína nunca devem ser administradas por via intravenosa. Incompatibilidades: CEFTRIAXONA SÓDICA não deve ser diluída em soluções contendo cálcio (por ex.: Solução de Hartmann e/ou Solução de Ringer). Instruções de uso: administração intramuscular: diluir a CEFTRIAXONA SÓDICA 500mg em 2mL de solução diluente (lidocaína 1%) e a CEFTRIAXONA SÓDICA 1g em 3,5mL de solução diluente (lidocaína 1%) e, então, administrar por injeção intramuscular profunda na região glútea ou em outro músculo relativamente grande. Recomenda-se não injetar mais que 1 g em cada glúteo.
Reações adversas.
A CEFTRIAXONA SÓDICA É GERALMENTE BEM TOLERADA. DURANTE O USO DE CEFTRIAXONA SÓDICA FORAM OBSERVADAS AS SEGUINTES REAÇÕES ADVERSAS REVERSÍVEIS ESPONTANEAMENTE OU APÓS A RETIRADA DO MEDICAMENTO. REAÇÕES ADVERSAS SISTÊMICAS: DISTÚRBIOS GASTRINTESTINAIS (CERCA DE 2% DOS CASOS), FEZES MOLES OU DIARRÉIA, NÁUSEA, VÔMITO, ESTOMATITE E GLOSSITE. ALTERAÇÕES HEMATOLÓGICAS (CERCA DE 2% DOS CASOS): EOSINOFILIA, LEUCOPENIA, GRANULOCITOPENIA, ANEMIA HEMOLÍTICA, TROMBOCITOPENIA; CASOS ISOLADOS DE GRANULOCITOPENIA ( < 500/MM3) FORAM RELATADOS, A MAIORIA DOS QUAIS APÓS 10 DIAS DE TRATAMENTO SEGUINDO A UMA DOSE TOTAL DE 20 G OU MAIS. REAÇÕES CUTÂNEAS (CERCA DE 1% DOS CASOS): EXANTEMA, DERMATITE ALÉRGICA, PRURIDO, URTICÁRIA, EDEMA E ERITEMA. CASOS ISOLADOS DE REAÇÕES ADVERSAS GRAVES FORAM RELATADOS TAIS COMO: ERITEMA MULTIFORME, SÍNDROME DE STEVENS-JOHNSON OU SÍNDROME DE LYEL NECROSE EPIDÉRMICA TÓXICA. REAÇÕES ADVERSAS RARAS: CEFALÉIA, TONTURA, ELEVAÇÃO DAS ENZIMAS HEPÁTICAS, SEDIMENTO SINTOMÁTICO DE CEFTRIAXONA CÁLCICA NA VESÍCULA BILIAR, OLIGÚRIA, AUMENTO DA CREATININA SÉRICA, MICOSE DO TRATO GENITAL, FEBRE, TREMORES, REAÇÕES ANAFILÁTICAS OU ANAFILACTÓIDES, AUMENTO DAS ENZIMAS HEPÁTICAS. ENTEROCOLITE PSEUDOMEMBRANOSA E DISTÚRBIOS DA COAGULAÇÃO FORAM DESCRITOS COMO REAÇÕES ADVERSAS RARÍSSIMAS. CASOS MUITO RAROS DE PRECIPITAÇÃO RENAL FORAM RELATADOS, PRINCIPALMENTE EM CRIANÇAS COM MAIS DE 3 ANOS QUE FORAM TRATADAS COM ALTAS DOSES DIÁRIAS (POR EX., DOSES MAIORES OU IGUAIS A 80MG/KG/DIA) OU COM DOSE TOTAL EXCEDENDO 10 GRAMAS, COM OUTROS FATORES DE RISCO PRESENTES (POR EX., RESTRIÇÃO DE FLUIDOS, CONFINAMENTO AO LEITO, ETC.). ESTE EVENTO PODENDO SER SINTOMÁTICO OU ASSINTOMÁTICO, PODE LEVAR À INSUFICIÊNCIA RENAL REVERSÍVEL COM A DESCONTINUAÇÃO DE CEFTRIAXONA SÓDICA.
Superdose.
Em casos de superdosagem a concentração da droga não pode ser reduzida por hemodiálise ou diálise peritoneal. Não há antídoto específico. O tratamento deve ser sintomático.
Pacientes idosos.
Devem-se seguir as orientações gerais descritas anteriormente.
Venda sob prescrição médica.
Para sua segurança mantenha esta embalagem até o uso total do medicamento.
Registro MS: 1.0043.0710.
CEFTRIAXONA (GENÉRICO)
EUROFARMA
IV
ceftriaxona sódica
Antibiótico.
USO ADULTO E PEDIÁTRICO. ADMINISTRAÇÃO INTRAVENOSA - DIRETA OU POR INFUSÃO CONTÍNUA.
Apresentações.
Ceftriaxona sódica 1g - pó para solução injetável para administração intravenosa. Embalagem com 50 frascos-ampola contendo o equivalente a 1 g de ceftriaxona e 50 ampolas de solução diluente com 10mL.
Composição.
Ceftriaxona sódica 1g: cada frasco-ampola contém: ceftriaxona sódica (equivalente a 1g de ceftriaxona) 1.197,00mg. Cada 1 grama de ceftriaxona sódica contém aproximadamente 83mg (3,6mEq) de sódio. Cada 1mL de solução diluente contém: água para injeção 1mL.
Informações ao paciente.
Ação esperada do medicamento: CEFTRIAXONA SÓDICA é um antibiótico cefalosporínico de amplo espectro e ação prolongada capaz de eliminar uma grande variedade de microrganismos responsáveis por diversos tipos de infecções, desde que estes microrganismos sejam sensíveis à ceftriaxona. Cuidados de armazenamento: conservar em local fresco. Proteger da luz. Após reconstituição, a solução obtida permanece estável físico e quimicamente por 6 horas a temperatura ambiente (entre 15°C e 30°C) ou por 24 horas sob refrigeração (entre 2°C e 8°C). Entretanto, como regra geral, as soluções devem ser utilizadas imediatamente após a preparação e qualquer porção não utilizada dentro dos prazos e condições descritos deve ser desprezada. A coloração varia de amarelo-pálido a âmbar, dependendo da concentração e do tempo de estocagem; esta particularidade da CEFTRIAXONA SÓDICA não tem qualquer significado quanto a sua tolerabilidade e eficácia. Prazo de validade: desde que observados os devidos cuidados de conservação, o prazo de validade de CEFTRIAXONA SÓDICA é de 24 meses, contados a partir da data de fabricação impressa em sua embalagem externa. NÃO USE MEDICAMENTOS COM O PRAZO DE VALIDADE VENCIDO. Gravidez e lactação: CEFTRIAXONA SÓDICA não deve ser administrada quando houver gravidez suspeita ou confirmada e/ou durante a lactação, a não ser que, a critério médico, os benefícios do tratamento esperados para a mãe superem os riscos potenciais para o feto. Deve-se ter cautela especialmente nos três primeiros meses de gestação. Informe ao seu médico a ocorrência de gravidez na vigência do tratamento ou após o seu término. Apesar da baixa concentração de CEFTRIAXONA SÓDICA encontrada no leite materno, durante o tratamento recomenda-se cuidado especial a pacientes que amamentam. Informe ao seu médico se está amamentando. Cuidados de administração: após reconstituição com a solução diluente apropriada, CEFTRIAXONA SÓDICA deve ser administrada exclusivamente por via intravenosa - direta ou por infusão contínua. Soluções diluentes contendo lidocaína não devem ser utilizadas para a administradas por via intravenosa. Siga a orientação do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Interrupção do tratamento: não interrompa o tratamento sem o conhecimento do seu médico; somente o médico poderá avaliar a eficácia da terapia. A interrupção do tratamento pode ocasionar a não obtenção dos resultados esperados. A duração do tratamento varia de acordo com a evolução da doença. Como recomendada na antibioticoterapia em geral, a administração de CEFTRIAXONA SÓDICA deve ser continuada durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obter-se evidências da erradicação da bactéria. Reações adversas: informe ao seu médico o aparecimento de reações desagradáveis. Somados aos ef
eitos benéficos do tratamento com CEFTRIAXONA SÓDICA é possível a ocorrência de efeitos indesejáveis durante o tratamento, mesmo quando este produto é utilizado corretamente. CEFTRIAXONA SÓDICA é bem tolerada pela maioria dos pacientes. As reações adversas mais comuns são as gastrintestinais como náusea, vômito, diarréia, estomatite e glossite; alterações hematológicas como eosinofilia, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia e reações cutâneas como exantema, prurido e urticária. TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS. Ingestão concomitante com outras substâncias: não são conhecidas interações deste medicamento com alimentos e álcool. Entretanto, recomenda-se não ingerir bebidas alcóolicas durante o tratamento. Contra-indicações e precauções: o uso deste medicamento é contra-indicado em caso de hipersensibilidade conhecida a CEFTRIAXONA SÓDICA, antibióticos do grupo das cefalosporinas e penicilinas. Informe ao seu médico sobre qualquer medicamento que esteja usando, antes do início, ou durante o tratamento. Pacientes que estejam fazendo uso de cloranfenicol não devem utilizar CEFTRIAXONA SÓDICA devido ao efeito antagônico observado in vitro. NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO, PODE SER PERIGOSO PARA A SAÚDE.
Informações técnicas.
Características: CEFTRIAXONA SÓDICA é um antibiótico cefalosporínico de amplo espectro e ação prolongada. Ceftriaxona ou (6R, 7R)-7-(Z)-2-(amino-4-tiazolil)-2-[metoxiimino]acetamido-3-[(2,5-diidro-6-hidroxi-2-metil-5-oxo-as-triazin-3-il)tio]metil-8-oxo-5-tia-1-azobiciclo[4,2,0]-oct-2-en-2-ácido carboxílico está presente sob a forma de sal dissódico. Microbiologia: a atividade bactericida de CEFTRIAXONA SÓDICA é devida à inibição da síntese da parede celular. A CEFTRIAXONA SÓDICA in vitro, é ativa contra um amplo espectro de microrgarnismos Gram-positivos e Gram-negativos, sendo altamente estável à maioria das betalactamases, cefalosporinases e penicilinases desses microrgarnismos. A CEFTRIAXONA SÓDICA é habitualmente ativa in vitro contra os microrgarnismos e infecções clínicas (vide Indicações). Aeróbios Gram-Positivos: Staphylococcus aureus (inclusive cepas produtoras de penicilinases), Staphylococcus coagulase-negativo, Streptococcus beta-hemolítico (grupo não-A não-B), Streptococcus pneumoniae, Streptococcus pyogenes (Streptococcus beta hemolítico do grupo A), Streptococcus agalactiae (Streptococcus beta hemolítico do grupo B) e Streptococcus viridans. Obs.: os estafilococos meticilina-resistentes são resistentes às cefalosporinas, inclusive a CEFTRIAXONA SÓDICA. Em geral, Enterococcus faecalis, Enterococcus faecium e Listeria monocytogenes são resistentes. Aeróbios Gram-negativos: Acinetobacter lwoffi, Acinetobacter anitratus (principalmente Acinetobacter baumanii), Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, bactéria Alcaligenes-like, Borrelia burgdoferi, Branhamella catarrhalis, Capnocytophaga spp., Citrobacter diversus (incluindo C. amalonaticus), Citrobacter freundii*, Escherichia coli, Enterobacter aerogenes*, Enterobacter cloacae* e Enterobacter spp. (outros)*, Haemophillus ducreyi, Haemophillus influenzae, Haemophillus parainfluenzae, Hafnia alvei, Klebsiella oxytoca e Klebsiella pneuymoniae**, Moraxella osloensis, Moraxella spp. (outras) e Moraxella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pastereulla multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri* e Proteus vulgaris, Pseudomonas fluorescens* e Pseudomonas spp., Providencia spp. e Providencia rettgeri*, Providencia spp. (outras), Salmonella typhi, Salmonella spp. (não tifóide), Serratia marcescens* e Serratia spp. (outras)*, Shigella spp., Vibrio spp., Yersinia enterocolitica e Yersinia spp. (outras). *Alguns isolados destas espécies são resistentes a CEFTRIAXONA SÓDICA principalmente devido à produção de betalactamase codificada cromossomicamente. **Alguns isolados destas espécies são resistentes devido à produção de betalactamase mediada por plasmídio, de espectro ampliado. Obs.: muitas cepas de microrganismos anteriormente mencionados que apresentam resistência a outros antibióticos, como por exemplo amino e ureidopenicilina, cefalosporinas mais antigas e aminoglicosídeos, são sensíveis a CEFTRIAXONA SÓDICA. Treponema pallidum é sensível a CEFTRIAXONA SÓDICA in vitro e em experimentação animal. Trabalhos clínicos (em andamento) indicam que tanto a sífilis primária como a secundária respondem bem ao tratamento com CEFTRIAXONA SÓDICA. Com poucas exceções clínicas, isolados de P. aeruginosa são resistentes à CEFTRIAXONA SÓDICA. Microrganismos anaeróbios: Bacterioides spp. (bile sensíveis)*, Clostridium spp. (exceto C. difiicile), Fusobacterium nucleatum, Fusobacterium spp. (outros), Gaffkia anaeróbica (anteriormente Peptococcus) e Peptostreptococcus ssp. Obs.: Muitas cepas de Bacteroides spp., produtoras de betalactamases (especialmente B. fragillis) são resistentes. Clostridium difficili é resistente. *Alguns isolados desta espécie são resistentes à produção de beta-lactamase. A sensibilidade à CEFTRIAXONA SÓDICA pode ser determinada por meio do teste de difusão com disco ou do teste de difusão com ágar ou caldo, usando técnicas padronizadas para testes de sensibilidade como as recomendadas pelo National Comittee for Clinical Laboratory Standards (NCCLS). O NCCLS fornece os seguintes parâmetros para a CEFTRIAXONA SÓDICA: testes de sensibilidade por diluição: sensível < 8mg/L; moderadamente sensível 16-32mg/L, resistentes > 64mg/L. Teste de sensibilidade por difusão usando disco com 30 mcg de CEFTRIAXONA SÓDICA: sensível > 21 mm, moderadamente sensível 20-14 mm, resistente < 13 mm. Os microrganismos devem ser testados com os discos de CEFTRIAXONA SÓDICA, uma vez que foi demonstrado in vitro que a CEFTRIAXONA SÓDICA é ativa contra certas cepas que se mostraram resistentes em discos da classe das cefalosporinas. Farmacocinética: a CEFTRIAXONA SÓDICA caracteriza-se por uma meia-vida de eliminação extraordinariamente longa de aproximadamente 8 horas, em adultos sadios. As áreas sob as curvas de concentração plasmática pelo tempo, após administração intramuscular e intravenosa são idênticas, ou seja, a biodisponibilidade da CEFTRIAXONA SÓDICA após administração intramuscular é de 100%. Distribuição: o volume de distribuição da CEFTRIAXONA SÓDICA é de 7 a 12 L. A CEFTRIAXONA SÓDICA mostrou excelente penetração tecidual, alcançando concentrações acima da Concentração Inibitória Mínima (C.I.M.) contra a maioria dos patógenos responsáveis pela infecção, e são detectáveis por mais de 24 horas em mais de 60 tecidos, incluindo pulmões, coração, fígado e vias biliares, amígdalas, ouvido médio, mucosa nasal, ossos e fluidos cérebro-espinhal, pleural, prostático e sinovial. Ligação protéica: a CEFTRIAXONA SÓDICA liga-se reversivelmente à albumina, diminuindo a ligação com o aumento da concentração. Assim, para uma concentração plasmática < 100 mcg/mL, a ligação protéica é de 95 %, enquanto para uma concentração de 300 mcg/mL a ligação é de 85%. Devido ao conteúdo mais baixo em albumina, a proporção de ceftriaxona livre no líquido intersticial é proporcionalmente mais alta que no plasma. Passagem para o líquido cefalorraquidiano: a CEFTRIAXONA SÓDICA atravessa as meninges inflamadas de lactente e crianças maiores. O grau de difusão média no líquido cefalorraquidiano (LCR) corresponde a 17% da concentração plasmática nos pacientes com meningite bacteriana e 4% em pacientes com meningite asséptica. Concentrações da CEFTRIAXONA SÓDICA > 1,4 mcg/mL foram encontradas no LCR, 24 horas após administração de 50-100mg/kg de CEFTRIAXONA SÓDICA por via intravenosa. Em pacientes adultos com meningite a administração de 50mg/kg produz, em 2 a 24 horas, concentrações no LCR muitas vezes superiores às Concentrações Inibitórias Mínimas (CIM) requeridas pela grande maioria dos microrganismos causadores da meningite. Metabolização: a CEFTRIAXONA SÓDICA não é metabolizada sistematicamente, mas convertida a metabólitos inativos pela microbiota intestinal. Eliminação: a meia-vida de eliminação em adultos sadios é de aproximadamente 8 horas. Em crianças com menos de 8 dias de vida e em adultos com mais de 75 anos, a meia-vida de eliminação é cerca de 2 vezes mais longa. Em adultos cerca de 50 a 60% são excretados na urina de forma inalterada, enquanto 40 a 50% são excretados na bile de forma inalterada. A microbiota intestinal transforma a CEFTRIAXONA SÓDICA em metabólitos microbiologicamente inativos. Nos recém nascidos, a eliminação urinária representa cerca de 70% da dose administrada. Em pacientes com insuficiência renal ou hepática a farmacocinética da CEFTRIAXONA SÓDICA é discretamente alterada, sendo a meia-vida de eliminação levemente aumentada. Se apenas a função renal está prejudicada, há um aumento na eliminação biliar; se, ao contrário, a função hepática está prejudicada, há um aumento na eliminação urinária. O clearence total do plasma é de 10-20mL/min. O clearence renal é de 5-12mL/min.
Indicações.
Infecções causadas por microrganismos sensíveis à CEFTRIAXONA SÓDICA, como por exemplo: sepse; meningite; borreliose de Lyme disseminada (estágios precoces e tardios da doença); infecções intra-abdominais (peritonites, infecções do trato gastrintestinal e biliar); infecções ósseas, articulares, tecidos moles, pele e feridas; infecções em pacientes com mecanismos de defesa comprometidos; infecções renais e do trato urinário; infecções do trato respiratório, particularmente pneumonia e infecções otorrinolaringológicas; infecções genitais, incluindo gonorréia; profilaxia de infecções pós-operatórias.
Contraindicações.
CEFTRIAXONA SÓDICA ESTÁ CONTRA-INDICADA EM PACIENTES COM CONHECIDA HIPERSENSIBILIDADE AOS ANTIBIÓTICOS DO GRUPO DAS CEFALOSPORINAS. EM PACIENTES HIPERSENSÍVEIS À PENICILINA DEVE-SE CONSIDERAR A POSSIBILIDADE DE REAÇÕES ALÉRGICAS CRUZADAS. CEFTRIAXONA SÓDICA NÃO DEVE SER ADICIONADA A SOLUÇÕES QUE CONTENHAM CÁLCIO COMO A SOLUÇÃO DE HARTMANN OU SOLUÇÕES DE RINGER. BASEADO EM ARTIGOS DE LITERATURA, CEFTRIAXONA SÓDICA É INCOMPATÍVEL COM ASACRINA, VANCOMICINA, FLUCONAZOL E AMINOGLICOSÍDEOS.
Precauções.
COMO COM OUTRAS CEFALOSPORINAS, A OCORRÊNCIA DE CHOQUE ANAFILÁTICO NÃO PODE SER AFASTADA, MESMO SEM ANTECEDENTES ALÉRGICOS. A OCORRÊNCIA DE CHOQUE ANAFILÁTICO EXIGE INTERVENÇÃO IMEDIATA. EM CASOS RAROS O EXAME ULTRASONOGRÁFICO DA VESÍCULA BILIAR REVELOU IMAGENS SUGESTIVAS DE SEDIMENTO. ESTES, GERALMENTE APÓS O USO DE DOSES MAIS ALTAS QUE O RECOMENDADO, DESAPARECEM COM A CONCLUSÃO OU DESCONTINUAÇÃO DO TRATAMENTO COM CEFTRIAXONA SÓDICA. RECOMENDA-SE TRATAMENTO CLÍNICO CONSERVADOR MESMO NOS CASOS EM QUE TAIS ACHADOS SE ACOMPANHAM DE SINTOMATOLOGIA DOLOROSA. FOI DESCRITA COLITE PSEUDOMEMBRANOSA COM QUASE TODOS OS AGENTES ANTIBACTERIANOS, INCLUINDO CEFTRIAXONA SÓDICA. PORTANTO É IMPORTANTE CONSIDERAR ESTE DIAGNÓSTICO EM PACIENTES QUE SE APRESENTAM COM DIARRÉIA SUBSEQUENTE À ADMINISTRAÇÃO DE AGENTES ANTIBACTERIANOS. ESTUDOS IN VITRO DEMONSTRARAM QUE CEFTRIAXONA SÓDICA, COMO OUTRAS CEFALOSPORINAS, PODE DESLOCAR A BILIRRUBINA DA ALBUMINA SÉRICA. CASOS DE PANCREATITE, POSSIVELMENTE DE ETIOLOGIA POR OBSTRUÇÃO BILIAR FORAM RELATADOS EM PACIENTES QUE UTILIZARAM CEFTRIAXONA SÓDICA. A MAIORIA DOS PACIENTES APRESENTAVAM FATORES DE RISCO PARA ESTASE BILIAR E BARRO BILIAR, POR EXEMPLO, TERAPIA PRINCIPAL ANTERIOR, DOENÇA GRAVE E NUTRIÇÃO PARENTERAL TOTAL. O PAPEL DE FATOR DESENCADEANTE OU DE COFATOR DA CEFTRIAXONA SÓDICA RELACIONADO À PRECIPITAÇÃO BILIAR NÃO PODE SER DESCARTADO. CEFTRIAXONA SÓDICA NÃO É RECOMENDADA PARA NEONATOS, ESPECIALMENTE PREMATUROS QUE APRESENTEM RISCO DE DESENVOLVER ENCEFALOPATIA DEVIDO À HIPERBILIRRUBINEMIA. DURANTE TRATAMENTOS PROLONGADOS, DEVE-SE FAZER CONTROLE REGULAR DO HEMOGRAMA. USO DURANTE A GRAVIDEZ E LACTAÇÃO: CEFTRIAXONA SÓDICA ATRAVESSA A BARREIRA PLACENTÁRIA. SUA SEGURANÇA DURANTE A GRAVIDEZ NÃO FOI ESTABELECIDA EM SERES HUMANOS. ESTUDOS DE REPRODUÇÃO EM ANIMAIS NÃO EVIDENCIARAM EMBRIO, FETO OU TERATOGENICIDADE, OU EFEITOS ADVERSOS SOBRE A FERTILIDADE (TANTO MASCULINA QUANTO FEMININA), O NASCIMENTO OU O DESENVOLVIMENTO PERI OU PÓS-NATAL. EM PRIMATAS NÃO FOI OBSERVADO EMBRIO OU TERATOGENICIDADE. COMO A CEFTRIAXONA SÓDICA É EXCRETADA NO LEITE EM BAIXAS CONCENTRAÇÕES, DURANTE O TRATAMENTO RECOMENDA-SE CUIDADO ÀS MULHERES QUE AMAMENTAM. EFEITOS SOBRE A HABILIDADE DE DIRIGIR VEÍCULOS E/OU OPERAR MÁQUINAS: NÃO HÁ EVIDÊNCIAS DE QUE CEFTRIAXONA SÓDICA DIMINUA A HABILIDADE DE DIRIGIR VEÍCULOS E/OU OPERAR MÁQUINAS.
Interações medicamentosas.
ATÉ O MOMENTO NÃO FOI OBSERVADA QUALQUER ALTERAÇÃO DA FUNÇÃO RENAL APÓS ADMINISTRAÇÃO SIMULTÂNEA DE DOSES ELEVADAS DE CEFTRIAXONA SÓDICA E POTENTES DIURÉTICOS COMO FUROSEMIDA, EM ALTAS DOSES. NÃO EXISTE TAMBÉM QUALQUER EVIDÊNCIA DE QUE CEFTRIAXONA SÓDICA AUMENTE A TOXICIDADE DOS AMINOGLICOSÍDEOS. CEFTRIAXONA SÓDICA NÃO APRESENTOU EFEITO SIMILAR AO PROVOCADO PELO DISSULFIRAM APÓS ADMINISTRAÇÃO DE ÁLCOOL. A CEFTRIAXONA SÓDICA NÃO CONTÉM O RADICAL N-METILTIOTETRAZOL, QUE ESTÁ ASSOCIADO A UMA POSSÍVEL INTOLERÂNCIA E A SANGRAMENTOS OBSERVADOS COM OUTRAS CEFALOSPORINAS. A PROBENECIDA NÃO TEM INFLUÊNCIA SOBRE A ELIMINAÇÃO DA CEFTRIAXONA SÓDICA. EM ESTUDOS IN VITRO, EFEITOS ANTAGÔNICOS FORAM OBSERVADOS COM O USO COMBINADO DE CLORANFENICOL E CEFTRIAXONA SÓDICA. ALTERAÇÃO NOS EXAMES CLÍNICOS E LABORATORIAIS: NOS PACIENTES TRATADOS COM CEFTRIAXONA SÓDICA O TESTE DE COOMBS PODE RARAMENTE TORNAR-SE FALSO-POSITIVO, ASSIM COMO O TESTE PARA GALACTOSEMIA. OS MÉTODOS NÃO ENZIMÁTICOS PARA DETERMINAÇÃO DE GLICOSE NA URINA PODEM FORNECER RESULTADOS FALSO-POSITIVOS. POR ESSE MOTIVO A DETERMINAÇÃO DE GLICOSE NA URINA DEVE SER FEITA POR MÉTODOS ENZIMÁTICOS.
Posologia e modo de usar.
Adultos e crianças acima de 12 anos: a dose usual é de 1 - 2 g de CEFTRIAXONA SÓDICA em dose única diária (cada 24 horas). Em casos graves ou em infecções causadas por patógenos moderadamente sensíveis, a dose pode ser elevada para 4 g, uma vez ao dia. Recém-nascidos (abaixo de 14 dias): dose única diária de 20-50mg/kg. Não ultrapassar 50mg/kg devido à imaturidade dos sistemas enzimáticos destes recém-nascidos. Não é necessário diferenciar crianças prematuras de crianças nascidas a termo. Lactentes e crianças (15 dias até 12 anos): dose única diária de 20-80mg/kg. Para crianças com 50 kg ou mais deve ser usada a posologia de adultos. Doses intravenosas maiores ou iguais a 50mg/kg de peso corpóreo devem ser administradas por infusão intravenosa por período de infusão superior a 30 minutos. Pacientes idosos: as doses para adultos não precisam ser alteradas em pacientes geriátricos. Duração do tratamento: a duração do tratamento irá variar de acordo com a evolução da doença. Como se recomenda na antibioticoterapia em geral, a administração de CEFTRIAXONA SÓDICA deve ser continuada durante um período mínimo de 48 a 72 horas após o desaparecimento da febre ou após obter-se evidências da erradicação da bactéria. Terapêutica associada: foi demonstrado, em condições experimentais, um sinergismo entre CEFTRIAXONA SÓDICA e aminoglicosídeos para muitos bacilos Gram-negativos. Embora não se possa prever sempre um aumento de atividade com esta associação, este sinergismo deve ser considerado nas infecções graves com risco de vida causada por Pseudomona aeruginosa. Devido à incompatibilidade física, os medicamentos devem ser administrados separadamente, nas doses recomendadas. Instruções posológicas especiais. Meningite bacteriana: na meningite bacteriana de lactentes e crianças deve-se iniciar o tratamento com 100mg/kg em dose única diária. Logo que o microrganismo responsável tenha sido identificado e sua sensibilidade determinada, pode-se reduzir a posologia. Os melhores resultados foram obtidos com os seguintes tempos de tratamento: Neisseria meningitidis: 4 dias; Haemophilus influenzae: 6 dias; Streptococcus pneumoniae: 7 dias. Gonorréia: para o tratamento da gonorréia causada por cepas produtoras e não-produtoras de penicilinase recomenda-se uma dose única de 250mg. Borreliose de Lyme (Doença de Lyme): a dose preconizada é de 50mg/kg até o total de 2g em crianças e adultos, durante 14 dias, em dose única diária. Profilaxia no pré-operatório: para previnir infecção pós-operatória em cirurgia contaminada ou potencialmente contaminada, recomenda-se 1 a 2g de CEFTRIAXONA SÓDICA 30 a 90 minutos antes da cirurgia. Em cirurgia colo-retal a administração com ou sem associação de um derivado 5-nitroimidazólico mostrou-se eficaz. Insuficiências hepática e renal: não é necessário diminuir a dose em pacientes com insuficiência renal desde que a função hepática esteja normal. Somente nos casos em que o clearance de creatinina for menor que 10mL por minuto a dose de CEFTRIAXONA SÓDICA não deve ser superior a 2g/dia. Não é necessário diminuir a dose de CEFTRIAXONA SÓDICA em pacientes com insuficiência hepática desde que a função renal se manhtenha normal. Nos casos de insuficiências hepática e renal graves e concomitantes deve-se determinar a concentração plasmática de CEFTRIAXONA SÓDICA a intervalos regulares e a dose deve ser ajustada. Em pacientes sob diálise não há necessidade de doses suplementares após diálise. Entretanto as concentrações séricas devem ser monitoradas, afim de avaliar a necessidade de ajuste na posologia, pois a taxa de eliminação pode ser reduzida nestes pacientes. Administração: CEFTRIAXONA SÓDICA deve ser administrada por via intravenosa direta ou por infusão contínua. Incompatibilidades: CEFTRIAXONA SÓDICA não deve ser diluída em soluções contendo cálcio (por ex.: Solução de Hartmann e/ou Solução de Ringer). Instruções de uso. Administração intravenosa: diluir a CEFTRIAXONA SÓDICA 1g em 10mL de água para injeção e, então, administrar por via intravenosa direta, durante 2 a 4 minutos. Infusão contínua: a infusão deve ser administrada em, pelo menos, 30 minutos. Para infusão intravenosa, 2g de CEFTRIAXONA SÓDICA são diluídos em 40mL das seguintes soluções: cloreto de sódio 0,9%; cloreto de sódio 0,45% + dextrose 5%, dextrose 10%; dextram 6% em dextrose 5%; infusão de amino-hidroxietil 6-10%; água para injeção. A solução de CEFTRIAXONA SÓDICA não deve ser diluída em frasco com outros antimicrobianos ou com outras soluções que não estas citadas anteriormente.
Reações adversas.
A CEFTRIAXONA SÓDICA É GERALMENTE BEM TOLERADA. DURANTE O USO DE CEFTRIAXONA SÓDICA FORAM OBSERVADAS AS SEGUINTES REAÇÕES ADVERSAS REVERSÍVEIS ESPONTANEAMENTE OU APÓS A RETIRADA DO MEDICAMENTO: REAÇÕES ADVERSAS SISTÊMICAS: DISTÚRBIOS GASTRINTESTINAIS (CERCA DE 2% DOS CASOS), FEZES MOLES OU DIARRÉIA, NÁUSEA, VÔMITO, ESTOMATITE E GLOSSITE. ALTERAÇÕES HEMATOLÓGICAS (CERCA DE 2% DOS CASOS): EOSINOFILIA, LEUCOPENIA, GRANULOCITOPENIA, ANEMIA HEMOLÍTICA, TROMBOCITOPENIA; CASOS ISOLADOS DE GRANULOCITOPENIA ( < 500/MM3) FORAM RELATADOS, A MAIORIA DOS QUAIS APÓS 10 DIAS DE TRATAMENTO SEGUINDO A UMA DOSE TOTAL DE 20G OU MAIS. REAÇÕES CUTÂNEAS (CERCA DE 1% DOS CASOS): EXANTEMA, DERMATITE ALÉRGICA, PRURIDO, URTICÁRIA, EDEMA E ERITEMA. CASOS ISOLADOS DE REAÇÕES ADVERSAS GRAVES FORAM RELATADOS TAIS COMO: ERITEMA MULTIFORME, SÍNDROME DE STEVENS-JOHNSON OU SÍNDROME DE LYEL NECROSE EPIDÉRMICA TÓXICA. REAÇÕES ADVERSAS RARAS: CEFALÉIA, TONTURA, ELEVAÇÃO DAS ENZIMAS HEPÁTICAS, SEDIMENTO SINTOMÁTICO DE CEFTRIAXONA CÁLCICA NA VESÍCULA BILIAR, OLIGÚRIA, AUMENTO DA CREATININA SÉRICA, MICOSE DO TRATO GENITAL, FEBRE, TREMORES, REAÇÕES ANAFILÁTICAS OU ANAFILACTÓIDES, AUMENTO DAS ENZIMAS HEPÁTICAS. ENTEROCOLITE PSEUDOMEMBRANOSA E DISTÚRBIOS DA COAGULAÇÃO FORAM DESCRITOS COMO REAÇÕES ADVERSAS RARÍSSIMAS. CASOS MUITO RAROS DE PRECIPITAÇÃO RENAL FORAM RELATADOS, PRINCIPALMENTE EM CRIANÇAS COM MAIS DE 3 ANOS QUE FORAM TRATADAS COM ALTAS DOSES DIÁRIAS (POR EX., DOSES MAIORES OU IGUAIS A 80MG/KG/DIA) OU COM DOSE TOTAL EXCEDENDO 10 GRAMAS, COM OUTROS FATORES DE RISCO PRESENTES (POR EX., RESTRIÇÃO DE FLUIDOS, CONFINAMENTO AO LEITO, ETC.). ESTE EVENTO PODE SER SINTOMÁTICO OU ASSINTOMÁTICO, PODENDO LEVAR À INSUFICIÊNCIA RENAL REVERSÍVEL COM A DESCONTINUAÇÃO DE CEFTRIAXONA SÓDICA. REAÇÕES ADVERSAS LOCAIS: EM RAROS CASOS PODE OCORRER FLEBITE APÓS A ADMINISTRAÇÃO INTRAVENOSA DE CEFTRIAXONA SÓDICA, QUE PODEM SER MINIMIZADA PELA ADMINISTRAÇÃO LENTA (2-4 MINUTOS).
Superdose.
Em casos de superdosagem a concentração da droga não pode ser reduzida por hemodiálise ou diálise peritoneal. Não há antídoto específico. O tratamento deve ser sintomático.
Pacientes idosos.
Devem-se seguir as orientações gerais descritas anteriormente.
Venda sob prescrição médica.
Para sua segurança mantenha esta embalagem até o uso total do medicamento.
Registro MS: 1.0043.0706.
Laboratorio que comercializa Ceftriaxona SÓdica Eurofarma
EUROFARMA →

